Pruebas saber concentración soluciones
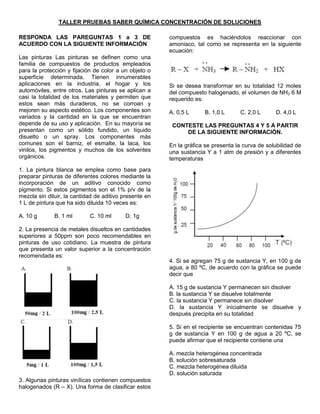
- 1. TALLER PRUEBAS SABER QUÍMICA CONCENTRACIÓN DE SOLUCIONES RESPONDA LAS PAREGUNTAS 1 a 3 DE ACUERDO CON LA SIGUIENTE INFORMACIÓN Las pinturas Las pinturas se definen como una familia de compuestos de productos empleados para la protección y fijación de color a un objeto o superficie determinada. Tienen innumerables aplicaciones en la industria, el hogar y los automóviles, entre otros. Las pinturas se aplican a casi la totalidad de los materiales y permiten que estos sean más duraderos, no se corroan y mejoren su aspecto estético. Los componentes son variados y la cantidad en la que se encuentran depende de su uso y aplicación. En su mayoría se presentan como un sólido fundido, un líquido disuelto o un spray. Los componentes más comunes son el barniz, el esmalte, la laca, los vinilos, los pigmentos y muchos de los solventes orgánicos. 1. La pintura blanca se emplea como base para preparar pinturas de diferentes colores mediante la incorporación de un aditivo conocido como pigmento. Si estos pigmentos son el 1% p/v de la mezcla sin diluir, la cantidad de aditivo presente en 1 L de pintura que ha sido diluida 10 veces es: A. 10 g B. 1 ml C. 10 ml D. 1g 2. La presencia de metales disueltos en cantidades superiores a 50ppm son poco recomendables en pinturas de uso cotidiano. La muestra de pintura que presenta un valor superior a la concentración recomendada es: 3. Algunas pinturas vinílicas contienen compuestos halogenados (R – X). Una forma de clasificar estos compuestos es haciéndolos reaccionar con amoniaco, tal como se representa en la siguiente ecuación: Si se desea transformar en su totalidad 12 moles del compuesto halogenado, el volumen de NH3 6 M requerido es: A. 0,5 L B. 1,0 L C. 2,0 L D. 4,0 L CONTESTE LAS PREGUNTAS 4 Y 5 A PARTIR DE LA SIGUIENTE INFORMACIÓN. En la gráfica se presenta la curva de solubilidad de una sustancia Y a 1 atm de presión y a diferentes temperaturas 4. Si se agregan 75 g de sustancia Y, en 100 g de agua, a 80 ºC, de acuerdo con la gráfica se puede decir que A. 15 g de sustancia Y permanecen sin disolver B. la sustancia Y se disuelve totalmente C. la sustancia Y permanece sin disolver D. la sustancia Y inicialmente se disuelve y después precipita en su totalidad 5. Si en el recipiente se encuentran contenidas 75 g de sustancia Y en 100 g de agua a 20 ºC, se puede afirmar que el recipiente contiene una A. mezcla heterogénea concentrada B. solución sobresaturada C. mezcla heterogénea diluida D. solución saturada
- 2. CONTESTE LAS PREGUNTAS 6 Y 7 A PARTIR DE LA SIGUIENTE INFORMACIÓN. Al reaccionar una solución acuosa de AgNO3 con una solución acuosa de KCl, se obtiene un producto insoluble en agua y otro soluble. La reacción se muestra en la siguiente ecuación AgNO 3 (ac) + KCl(ac) AgCl(s) + KNO 3(ac) Se llevan a cabo dos ensayos, las cantidades utilizadas se reportan en la siguiente tabla. El KNO3 es menos soluble en agua que el KCl a bajas temperaturas 6. Una vez finalizada la reacción del ensayo 2, se filtra y se disminuye la temperatura de la solución hasta 5 o C. Cuando el líquido se encuentra a esta temperatura se forma un sólido que probablemente es A. KCI B. AgNO3 C. AgCI D. KNO 3 7. El número de moles de KCl empleados en el ensayo 2, con respecto al ensayo 1 es A. Igual C. el doble B. el triple D. la mitad 8. La cantidad de gramos de hidróxido de sodio (NaOH) que se requieren para preparar 1 litro de una solución 1M es (Masa-fórmula-gramo NaOH: 40 gramos/mol, porcentaje de pureza 99 %) A. 20.20 B. 39.60 C. 40.00 D. 40.40 9. ¿En cuál de los recipientes mostrados en la figura, hay menor cantidad de NaOH disuelto? 10. Una solución contiene 20 gramos de cloruro de sodio (NaCl) disueltos en 80 gramos de agua (H2O). La concentración de esta solución equivale a A. 20% p/v C. 20% peso a volumen B. 25% v/p D. 25% volumen a peso 11. Las diferentes mezclas que se preparan con NaCl y H2O pueden representarse en un segmento de recta, en el cual, los extremos indican las sustancias puras, y los puntos intermedios representan el valor del porcentaje peso a peso de cada componente en la mezcla. Se tiene una solución de NaCl en agua, cuya concentración se indica en el punto 1 de la gráfica. Si a través de algún proceso experimental, el valor de la concentración cambia del indicado en el punto 1 al punto 2, es válido afirmar que A. disminuye la concentración de la solución de NaCl B. aumenta la cantidad de agua en la solución C. aumenta la concentración de la solución de NaCl D. permanece constante la cantidad de agua en la solución 12. La relación entre los componentes de una solución se conoce como concentración. Una expresión de la concentración de una solución es el porcentaje peso a peso (%p/p). Se preparan cuatro soluciones de cloruro de sodio y la concentración de cada solución se presenta en la siguiente tabla. La solución que tiene mayor cantidad de soluto disuelto por cada 100 g de solución es: A.3 B.4 C.1 D.2
- 3. 13. Utilizando 1 mol de la sustancia J y agua, se prepara un litro de solución. Si a esta solución se le adicionan 200 ml de agua, es muy probable que: A. Permanezca constante la concentración molar de la solución. B. Se aumente la concentración molar de la solución. C. Se disminuya la fracción molar de J en la solución. D. Permanezca constante la fracción molar de J en la solución. 14. Se preparó medio litro de una solución patrón de HCl 1M; de esta solución, se extrajeron 50 ml y se llevaron a un balón aforado de 100 ml, luego se completó a volumen añadiendo agua. Teniendo en cuenta esta información, es válido afirmar que el valor de la concentración en la nueva solución será igual: A. Al doble de la concentración en la solución patrón. B. A la cuarta parte de la concentración en la solución patrón. C. A la mitad de la concentración en la solución patrón. D. A la concentración en la solución patrón. CONTESTE LAS PREGUNTAS 15 Y 16 DE ACUERDO CON LA SIGUIENTE INFORMACIÓN A cuatro vasos que contienen volúmenes diferentes de agua se agrega una cantidad distinta de soluto X de acuerdo con la siguiente tabla. 15. De acuerdo con la situación anterior, es válido afirmar que la concentración es: A. Mayor en el vaso 3 B. Igual en los cuatro vasos C. Menor en el vaso 1 D. Mayor en el vaso 2 16. Si se evapora la mitad del solvente en cada uno de los vasos es muy probable que al final de la evaporación: A. Los cuatro vasos contengan igual masa de la sustancia X. B. La concentración de las cuatro soluciones sea igual. C. Disminuya la concentración de la solución del vaso dos. D. Aumente la masa de la sustancia X en los cuatro vasos. CONTESTE LAS PREGUNTAS 17 Y 18 DE ACUERDO CON LA SIGUIENTE INFORMACIÓN En el laboratorio se prepara una solución (a la que llamaremos solución A) pesando 74.5 g de KCl (masa molar 74.5 g/mol) y adicionando agua hasta completar 1.00 L de solución. De esta solución A, se toma una alícuota de 100 mL y se coloca en un matraz aforado de 250 mL, adicionando agua hasta la marca de aforo (solución B). Finalmente, de la solución B se toma una alícuota de 25 mL y se coloca en un vaso de precipitados. 17. De acuerdo con el enunciado inmediatamente anterior, la afirmación falsa es: A. La concentración molar de KCl en la alícuota de 25 mL y en la solución B es la misma. B. La solución B está más diluida que la solución A. C. El número de moles de KCl en la alícuota de 25 mL es menor que el número de moles de KCl en la solución B. D. La solución B tiene un menor número de moles de KCl que la solución A. 18. La concentración molar de KCl en la solución B debe ser A. 1.0 M B. 0.40 M C. 7.45 M D. 0.10 M
- 4. 19. En la etiqueta de un frasco de vinagre aparece la información: ―solución de ácido acético al 4% en peso‖ . Esta información indica que el frasco contiene A. 4 g de acido acético en 96 g de solución. B. 100 g de soluto y 4 g de ácido acético. C. 100 g de solvente y 4 g de ácido acético. D. 4 g de ácido acético y 100 g de solución. CONTESTE LAS PREGUNTAS 20 a 22 DE ACUERDO CON LA SIGUIENTE INFORMACIÓN En la tabla mostrada se presenta el punto de ebullición de dos compuestos químicos a una atmosfera de presión: Tres mezclas preparadas con ácido butanoico y agua, se representan en una recta donde los puntos intermedios indican el valor en porcentaje peso a peso (% p/p) de cada componente en la mezcla. 20. Al cambiar la concentración del ácido butanoico en la solución, del punto 1 al 2, es válido afirmar que, en ella A. El porcentaje de agua en la solución permanece constante. B. Disminuye la concentración de ácido butanoico en la solución. C. Disminuye la masa de agua en la solución D. Las concentraciones, tanto de agua como de ácido butanoico, permanecen constantes. 21. Para cambiar la concentración del ácido butanoico en la solución indicada en el punto 1, a la del punto 2, la técnica más adecuada es: A. Decantación C. Adición de agua B. Filtración D. Evaporación 22. A una atmosfera de presión, para cambiar la concentración del ácido butanoico en la solución indicada en el punto 2, a la del punto 3, el procedimiento más adecuado es A. Evaporar a 100ºC C. Evaporar a 184ºC. B. Filtrar D. Decantar. 23. A 100 mL de una solución acuosa de NaOH, de concentración 20 g/L, se le adiciona agua suficiente hasta completar 500 mL de solución. La concentración, en g/L, del NaOH en esta nueva solución es igual a: A. 20 g/L B. 100 g/L C. 4 g/L D. 5 g/L 24. La siguiente gráfica relaciona el número de moles de soluto disuelto en distintos volúmenes de una misma solución. De acuerdo con la gráfica, es correcto afirmar que de 200 mL a 400 mL, la concentración de soluto se ha: A. Incrementado en 5 mol/L. B. Incrementado en 1 mol/L. C. Mantenido constante D. Disminuido en 2 mol/L. 25. cuando se disuelve 10.3 g de NaBr (0.1 moles) y se completa a 1L de solución, con agua, se obtiene una solución de concentración equivalente a disolver A. 4.9 g de H2SO4 (masa molecular 98) en 250 mL agua. B. 8.2 g de H2SO3 (masa molar 82) en 250 mL de agua. C. 6.3 g de HNO3 (masa molecular 63) en 500 mL de agua
- 5. D. 4.9 g de H3PO4 (masa molar 98) en 500 mL de agua. CONTESTE LAS PREGUNTAS 26 a 28 DE ACUERDO CON LA SIGUIENTE TABLA 26. De acuerdo con la tabla, la solución con menor concentración es la A. D B. X C. R D. Z. 27. Si a la solución D se le adicionan 200 mL más de solvente, es probable que la solución final A. permanezca constante B. sea igual a la concentración de la solución X C. aumente la concentración D. sea igual a la concentración de la solución Z 28. si la solución X se somete a calentamiento hasta evaporar 100 mL es muy probable que A. aumente la masa del soluto B. aumente la concentración de la solución C. permanezca constante la concentración D. disminuya la densidad de la solución. 29. Para preparar 2 litros de una solución acuosa 1.5 M de la sustancia Q (masa molecular 60 g/mol), se requieren A. 30 g de Q C. 180 g de Q B. 60 g de Q D. 120 g de Q 30. 9. Se preparó medio litro de una solución patrón de HCl 1M; de esta solución, se extrajeron 50 ml y se llevaron a un balón aforado de 100 ml, luego se completó a volumen añadiendo agua. Teniendo en cuenta esta información, es válido afirmar que el valor de la concentración en la nueva solución será igual A. al doble de la concentración en la solución patrón B. a la cuarta parte de la concentración en la solución patrón C. a la mitad de la concentración en la solución patrón D. a la concentración en la solución patrón
