Formulacion y-tp
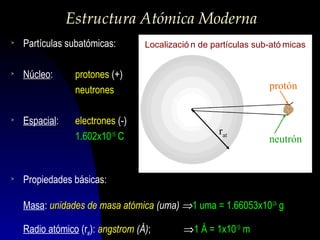
- 1. Estructura Atómica Moderna > Partículas subatómicas: > Núcleo: > > Espacial: Localizació n de partículas sub-ató micas protones (+) neutrones electrones (-) 1.602x10-19 C protón rat neutrón Propiedades básicas: Masa: unidades de masa atómica (uma) ⇒1 uma = 1.66053x10-24 g Radio atómico (rat): angstrom (Å); ⇒1 Å = 1x10-10 m
- 2. Estructura Atómica Moderna > Todos los á tomos de un elemento tienen el mismo nú mero de protones, nú mero al cual se le denomina NUMERO ATOMICO.(Z) > Atomos de un mismo elemento que difieren en el nú mero de neutrones, y por tanto en su masa, se denominan ISOTOPOS. > El nú mero total de protones má neutrones en el s á tomo, se denomina NUMERO DE MASA.(M)
- 3. Estructura Atómica Moderna Algunos de los isó topos del á tomo de carbono (C) símbolo nº protones nº electrones nº neutrones 11 C 6 6 5 12 C 6 6 6 13 C 6 6 7 14 C 6 6 8
- 4. La Tabla Periódica > Importantes esfuerzos de observació n y clasificació n de propiedades de los elementos, culminan en 1869 en el desarrollo de la tabla periódica > Varios elementos exhiben fuertes similitudes, p. ej., Li, Na y K son todos metales muy reactivos. He, Ne y Ar son gases inertes. El arreglo en orden creciente de su N.A., muestra regularidades perió dicas de sus propiedades. Número atómico Símbolo gas inerte metal muy reactivo gas inerte metal muy reactivo gas inerte metal muy reactivo
- 5. El arreglo de elementos en orden creciente de Z con elementos teniendo propiedades similares ubicadas en columnas verticales, se conoce como: Tabla Perió dica Moderna Metal Metaloide No metal
- 6. La Tabla Periodica: propiedades > Los elementos en una columna de la tabla se conocen como un grupo y, de acuerdo a la IUPAC (International Union of Pure and Applied Chemistry), la nueva convención numera los grupos de 1 a 18 sin designaciones adicionales de A o B. > Los elementos de un mismo grupo exhiben similitud en sus propiedades físicas y químicas. Algunos grupos presentan un nombre específico: Grupo 1A 2A 6A 7A 8A Nombre Metales alcalinos Metales alcalino-terreos Calcó genos Haló genos Gases nobles (o raros) Elementos Li, Na, K, Rb, Cs, Fr Be, Mg, Ca, Sr, Ba,Ra O, S, Se, Te, Po F, Cl, Br, I, At He, Ne, Ar, Kr, Xe,Rn
- 7. Moléculas y Compuestos Moleculares > Só lo los elementos de gases nobles se encuentran en la naturaleza como á tomos aislados. La mayoría de la materia se compone de moléculas o iones, los cuales a su vez estan formados de átomos. > Una molécula es una unión de dos o más átomos estrechamente enlazados unos a otros. > A resultas de la unió n, el ensamble de átomos se comporta como una única entidad de propiedades diferentes.
- 8. Moléculas y Compuestos Moleculares > Molé culas elementales. Dos o más átomos de la misma clase se combinan entre sí. Un caso típico lo constituye el oxígeno, cuyas fó rmulas son: O2 : oxígeno “normal”, esencial para la vida, gas incoloro e inodoro; O3 : ozono, tó xico, de olor picante e irritante de las mucosas. > Los elementos má comunes que existen como moléculas diatómicas s son: H2 5A 6A 7A N2 O2 F2 Cl2 Br2 I2
- 9. Compuestos moleculares > Compuestos moleculares. Contienen más de un tipo de átomos : por ej., la molé cula de agua: H2O : combinació n de 2 á tomos de H y 1 á tomo de O, o bien; H2O2 : Hidró geno y Oxígeno en diferente proporció n relativa. > > > Algunas molé culas comunes simples se presentan en el esquema. Es importante observar que: La composición de cada compuesto esta dada por su fórmula química; Agua, H 2 O Dió xido de carbono, CO 2 Monó xido de carbono, CO Metano CH 4 Peró xido de Oxígeno, O 2 hidró geno, H 2 O 2 Las sustancias aquí mostradas se componen de elementos no-metálicos. Ozono, O 3 Etileno C 2 H 4
- 10. Moléculas y Compuestos Moleculares > Fó rmula Molecular: Indica el número y tipo real de átomos en la molécula. Las fó rmulas anteriores son moleculares. Los subíndices son siempre multiplos enteros de los subíndices de las fó rmulas empíricas correspondientes. > Fó rmula Empírica: Indica sólo el número relativo de átomos de cada tipo en la molécula. Aquí, los subíndices indican siempre la relació n de nú meros enteros má pequeñ a. s Fórmula Molecular H2O2 C2H4 Fórmula Empírica HO CH2
- 11. Moléculas y Compuestos Moleculares > Fó rmula Estructural: Muestra qué átomos estan unidos a cuales dentro de la molécula. Las líneas entre los símbolos de los elementos representan las uniones químicas entre á tomos. Agua > Peróxido de hidrógeno Metano Una fó rmula estructural no exhibe la geometría real de la molé cula, esto es, los á ngulos verdaderos a los cuales está unidos los á n tomos. Sin embargo, se puede representar como un dibujo en perspectiva para dar un sentido tridimensional.
- 13. Iones y Compuestos Iónicos El núcleo de un átomo permanece inalterado en los procesos químicos, pero el átomo puede ganar o perder electrones con facilidad originando partículas cargadas denominadas IONES. Si la carga es positiva se llama CATION, si la carga es negativa se llama ANION. Sea, por ejemplo, el á tomo de sodio: pierde un electron ion de Na+ á tomo de Na Ahora, el á tomo de cloro: gana un electron á tomo de Cl ion de Cl-
- 14. Iones y Compuestos Iónicos > En general, los átomos de metales pierden electrones con facilidad y los átomos de los no metales tienden a ganar electrones. Dé el símbolo químico completo de: a) un ion con 26 p⊕, 30 n± y 24 e –; b) el ion fó sforo con 16 n± y 18 e –. a) El elemento con 26 p⊕ (nº ató mico = 26) es: Fe, cuyo nº de masa = 26 p⊕ + 30 n± = 56. Hay 2 cargas (+) en exceso, por tanto, la carga neta del ion es 2+ . El símbolo completo será : 56 2+ 26 Fe b) El P tiene un nº ató mico de 15, luego entonces tiene 15 p⊕, y un nº de masa de (15 p⊕ + 16 n±) 31. Tiene ademá una carga neta de 18 e – - 15 s p⊕ = 3 e –,o sea 3- , así que el símbolo será : 31 3− 15 P
- 15. Iones y Compuestos Iónicos > Iones Poliató micos.- Consisten de á tomos unidos como en una molé cu-la, pero con una carga neta positiva o negativa, p. ej.: (NO3 ) > - o 2− (SO4 ) ¿Có mo se predicen las cargas ionicas? Se parte de la idea de que la ganancia o pé rdida de electrones conduce a un á tomo a adquirir una configuració n de gas noble, como en el caso del Na y del Cl.
- 16. Iones y Compuestos Iónicos La tabla periodica es una herramienta ú para recordar las cargas de los til iones, en especial los de los extremos de la misma. g a s e s n o b l e s Metales de transició n Metales alcalinos (+2) Metales alcalinos (+1) Calcógenos (-2) Halógenos (-1)
- 17. Iones y Compuestos Iónicos Compuestos ió nicos.- Aquellos que contienen iones cargados positivamente y iones cargados negativamente. pierde un electron Atomo de Na neutro gana un electron Atomo de Cl neutro De la composició n podemos saber, frecuentemente, si es compuesto ió nico (constituido por iones) o molecular (constituido por molé culas).
- 18. Iones y Compuestos Iónicos En general, los metales forman catió nes y los no-metales anió nes. Por tanto, los compuestos ió nicos son en general combinaciones de metales y no-metales (p.ej. NaCl), en tanto que los moleculares se componen en general ú nicamente de no-metales (H2O). > ¿Qué especies se espera sean ió nicas?: N2O, Na2O, CaCl2 y SF4. > ¿Qué especies se espera sean moleculares?: Cl2, FeS, PbF2 y P4O6.
- 19. Iones y Compuestos Iónicos > Sólo se pueden escribir fórmulas empíricas para los compuestos iónicos, y si no estan en forma ió nica, siempre son elé ctricamente neutros, así que las cargas deberán estar balanceadas. > ¿Cuá les son las fó rmulas empíricas de los compuestos formados por los iones?: a) Al3+ y Cl- ; b) Al3+ y O2- ; c) Mg2+ y NO3-
