Reacciones químicas (semana 7)
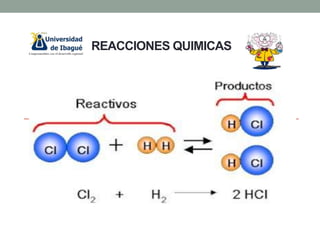
- 2. EJEMPLOS DE REACCIONES QUIMICAS • 4Fe + 3O2 2 Fe2O3 ( Oxidación de una puntilla ) • 2H2 + O2 2 H2O ( Formación de agua ) • CH4 + 2O2 CO2 + 2H2O ( Combustión del metano ) Partes de una reacción química A + B C + D REACTIVOS PRODUCTOS PRODUCE
- 3. REACCIONES QUIMICAS II TIPOS • 1. Reacciones según el intercambio energético • Endotérmicas (con absorción de calor del medio ambiente) • Exotérmicas (con liberación de calor al medio ambiente) • Isotérmicas (sin absorción ni liberación de calor al medio ambiente) 2.Reacciones según los compuestos que intervienen. • De combinación o síntesis A + B AB • De descomposición o análisis. AB A + B • De desplazamiento. • AB + C CB + A • De doble desplazamiento o intercambio • AB + CD AD + CB 3. Reacciones según el movimiento de electrones • Sin transferencia de electrones. ( neutralización ) • Con transferencia de electrones •
- 4. REACCIONES QUIMICAS II CONCEPTO DE MOL PESO ATÓMICO DE UN ELEMENTO O MOLECULAR DE UN COMPUESTO EXPRESADO EN GRAMOS MOL.- Cantidad de sustancia que contiene el mismo número de unidades elementales (átomos, moléculas, iones, etc.) que el número de átomos presentes en 12 gramos de carbono 12. 1 MOL de un elemento = 6.022 x 10átomos
- 5. CUADRO COMPARATIVO DE MOLES NUMERO DE AVOGADRO Moles Átomos Gramos 1 mol de S 6.023 x 10²³ 32.06g 1 mol de P 6.023 x 10²³ 30.97g 1 mol de Cu 6.023 x 10²³ 63.54g 1 mol de N 6.023 x 10²³ 14.008g 1 mol de K 6.023 x 10²³ 39.10g 1 Mol de Al 6.023 x 10²³ 26.991g
- 6. LEYES QUE RIGEN EL COMPORTAMIENTO ESTEQUIOMÉTRICO 1. LEY DE LAVOISIER LEY DE LA CONSERVACION DE LA MATERIA Como hecho científico la idea de que la masa se conserva se remonta al químico Lavoisier, el científico francés considerado padre de la Química moderna que midió cuidadosamente la masa de las sustancias antes y después de intervenir en una reacción química, y llegó a la conclusión de que la materia, medida por la masa, no se crea ni destruye, sino que sólo se transforma en el curso de las reacciones
- 7. LEYES QUE RIGEN EL COMPORTAMIENTO ESTEQUIOMETRICO 2. LEY DE PROUST La ley de las proporciones constantes o ley de las proporciones definidas es una de las leyes estequiométricas, según la cual «Cuando se combinan dos o más elementos para dar un determinado compuesto, siempre lo hacen en una relación de masas constantes».
- 8. LEYES QUE RIGEN EL COMPORTAMIENTO ESTEQUIOMETRICO 3. LEY DE DALTON • La ley de Dalton o ley de las proporciones múltiples formulada en 1803 por John Dalton, es una de las leyes estequiométricas más básicas. Fue demostrada por el químico y físico francés Louis Joseph Gay-Lussac. • Cuando un elemento se combina con otro para dar más de un compuesto, las masas de uno de ellos que se unen a una masa fija del otro están en relación de números enteros y sencillos". • Cl2 + O2 Cl2O • Cl2O3 • Cl2O5 • Cl2O7