გაკვეთილი № 17 2
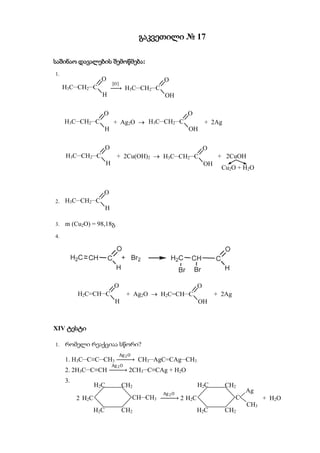
- 1. გაკვეთილი № 17 საშინაო დავალების შემოწმება: 1. O O O H3CCH2C H3CCH2C H OH O O H3CCH2C + Ag2O H3CCH2C + 2Ag H OH O O H3CCH2C + 2Cu(OH)2 H3CCH2C + 2CuOH H OH Cu2O + H2O O 2. H3CCH2C H 3. m (Cu2O) = 98,18გ 4. O O H2C=CHC + Ag2O H2C=CHC + 2Ag H OH XIV ტესტი 1. რომელი რეაქციაა სწორი? Ag 2 O 1. H3CC≡CCH3 CH3AgC=CAgCH3 Ag 2 O 2. 2H3CC≡CH 2CH3C≡CAg + H2O 3. H2C CH2 H2C CH2 Ag 2 O Ag 2 H2C CHCH3 2 H2C C + H2 O CH3 H2C CH2 H2C CH2
- 2. -2- Ag 2 O 4. H3CCH=CH2 CH3CH=CAg2 + H2O 2. რომელი დებულებაა მცდარი? 1. ბენზინის დეტონაციისადმი მედეგობის შესადარებელი ეტალონები მზადდება ნორმალური ჰეპტანისა და იზოოქტანისაგან 2. ნარევში იზოოქტანის მასური წილი გვიჩვენებს ეტალონის ოქტანურ რიცხვს 3. ნარევში ნორმალური ჰეპტანის მასური წილი გვიჩვენებს ეტალონის ოქტანურ რიცხვს 4. ნ. ჰეპტანის დეტონაციური მედეგობა 0-ის ტოლია 3. 3-მეთილ ბუტანოლ-1-ის ფორმულაა: 1. H3CCHCH2CH3 CH3 2. H3CCHCH2CH2OH CH3 3. H3CCH2CHOH CH3 4. H3CCHCH2CH3 OH 4. რომელი რეაქციაა მცდარი? 1. H3CCH=CH2 + H2O H3CCH2CH2OH 2. H3CCH=CH2 + H2O H3CCHCH2OH OH 3. H2C=CH2 + H2O H3CCH2OH OH 4. H3CC=CH2 + H2O H3CCCH3 CH3 CH3
- 3. -3- 5. რომელი ფორმულაა არასწორი? OH 1. H3CCHCH2OH 2. H3CCCH2OH OH OH 3. H3CCHCH2CH3 4. H3CCHCHCH3 OH OH OH 6. გლიკოლი შეიძლება მივიღოთ: 1. აცეტილენის დაჟანგვით 2. ცხიმების ჰიდროლიზით 3. გლიცერინის დეჰირატაციით 4. ეთილენის დაჟანგვით 7. რომელი რეაქციაა მცდარი? 1. C6H5OH + NaOH C6H5ONa + H2O 2. C6H5OH + 3HNO3 C6H5(NO2)3 + H2O 3. C6H5CH2OH + NaOH C6H5CH2ONa + H2O 4. 2C6H5CH2OH + 2Na 2C6H5CH2ONa + H2 8. ალდეჰიდების აღმომჩენი რეაქციაა: O O 1. RC + O RC H OH O O 2. მხოლოდ RC + Ag2O RC + 2Ag H OH O O 3. მხოლოდ RC + 2Cu(OH)2 RC + Cu2O + H2O H OH 4. (2) და (3) რეაქციები O C H O O 9. სამი ფორმულიდან: 1. H3CCH=CHC 2. HC 3. H H
- 4. -4- ალდეჰიდებია 1. მხოლოდ (3) 2. (1) და (3) 3. (1) და (2) 4. სამივე 10. რომელი დებულებაა მცდარი? 1. პოლიკონდენსაციის და პოლიმერიზაციის რეაქციები ერთმანეთისგან არაფრით განსხვავდება 2. ფენოლ-ფორმალდეჰიდური ფისების მიღების რეაქცია პოლიკონდენსაციის ტიპიური მაგალითია 3. პოლიმერიზაციისგან განსხვავებით, პოლიკონდენსაციის დროს ადგილი აქვს წყლის გამოყოფას 4. ფორმალდეჰიდი ერთადერთი ალდეჰიდია, რომელის ერთ მოლთან ორი მოლი ვერცხლის ოქსიდი შედის რეაქციაში კარბონმჟავები კარბონმჟავების ზოგადი ფორმულაა O RC OH კარბოქსილის ჯგუფის შედგენილობაა O C OH კარბოქსილის ჯგუფის ჟანგბადის ატომი იზიდავს ორმაგი ბმის ელექტრონულ წყვილს, რის შედეგადაც კარბონილის ნახშირბადატომზე წარმოიქმნება ნაწილობრივი დადებითი მუხტი. ამ მუხტის ჩასაქრობად ჰიდროქსილის ჟანგბად ატომის თავისუფალი ელექტრონული წყვილი გადაიხრება ნახშირბადატომისაკენ, რაც თავის მხრივ იწვევს OH ბმის საზიარო ელექტრონული წყვილის კიდევ უფრო მკვეთრად გადახრას ჟანგბადის ატომისაკენ.
- 5. -5- ელექტრონული სიმკვრივეების ასეთი გადანაწილება აადვილებს კარბონმჟავების მოლეკულიდან წყალბადის კათიონის მოწყვეტას ანუ მჟავურ დისოციაციას: RCOOH RCOO─ + H+ ნაჯერი ერთფუძიანი მჟავების ჰომოლოგიური რიგის ზოგადი ფორმულაა O CnH2n+1C სადაც n=0,1,2…… ან CnH2nO2 სადაც n=1,2... OH O HC მეთანმჟავა, ჭიანჭველმჟავა H O CH3C ეთანმჟავა, ძმარმჟავა OH O CH3CH2C პროპანმჟავა, პროპიონმჟავა OH O H3CCH2CH2C ბუტანმჟავა, ერბოს მჟავა OH O C3H7C H O H3CCHC 2-მეთილპროპანმჟავა, იზოერბოს მჟავა CH3 OH ზოგადად სისტემატური ნომენკლატურის შესაბამისად მჟავების სახელწოდება იწარმოება შესაბამისი ნახშირწყალბადის სახელზე დაბოლოება მჟავას დამატებით.
- 6. -6- ამასთან ნახშირბადოვანი ჯაჭვის პირველი ნახშირბადი კარბოქსილის ნახშირბადია. მაგ: 4-მეთილ-2-ეთილპენტანმჟავა ბუნებაში დიდი რაოდენობით გვხვდება ნაერთები, რომლებიც მაღალი მოლეკულური მასის მქონე ნაჯერი მჟავების ნაწარმებს წარმოადგენენ. ეს მჟავებია: H3C(CH2)14COOH ანუ C15H31COOH პალმიტინის მჟავა H3C(CH2)16COOH ანუ C17H35COOH სტეარინის მჟავა ზოგადად ორგანული რადიკალის ზრდასთან ერთად სუსტდება კარბონმჟავების მჟავური ბუნება. მჟავების მიღების ზოგადი ხერხია შესაბამისი პირველადი სპირტების დაჟანგვა: O O O O RCH2OH RC RC H OH სპირტი ალდეჰიდი მჟავა კარბონმჟავების პირველი წარმომადგენლები სითხეებია. წყალში იხსნებიან. R რადიკალის ზრდასთან ერთად იკლებს მათი ხსნადობა.
- 7. -7- ზოგიერთი ორგანულ მჟავის ფიზიკური თვისებები ლღობის დუღილის სიმკვრივე ფორმულა სახელწოდება ტემპ. oC ტემპ. oC გ/სმ3 HCOOH ჭიანჭველმჟავა, 8,4 105,5 1,220 მეთანმჟავა H3CCOOH ძმარმჟავა, 16,6 118,2 1,049 ეთანმჟავა H5C2COOH პროპიონის, -22,0 141,1 0,998 პროპანმჟავა H7C3COOH ერბოს მჟავა, 7,9 163,5 0,964 ბუტანმჟავა H11C5COOH კაპრონის, -3,9 205,8 0,922 ჰექსანმჟავა H31C15COOH პალმიტინის, 62,8 139 (133 პა) 0,841 პენტადეკანმჟავა 80oC-ზე H35C17COOH სტეარინის, 69,6 160 (133 პა) 0,839 ოქტადეკანმჟავა 80oC-ზე H2C=CHCOOH აკრილის, 12 142 1,062 პროპენმჟავა H33C17COOH ოლეინმჟავა 14 233 (1995 პა) 0,898 14oC-ზე H5C6COOH ბენზოის მჟავა 122 240 1,264 ქიმიური თვისებები: ორგანული მჟავები მინერალურ მჟავებთან შედარებით სუსტი მჟავებია. ამ მჟავათა დისოციაციის ხარისხი (0,1 მოლი/ლ კონცენტრაცია და 250C) 3%-ს არ აღემატება. საშუალო სიძლიერის მჟავებს მიეკუთვნება მხოლოდ ჭიანჭველმჟავა. R – ჯგუფის ბუნება ზეგავლენას ახდენს კარბონმჟავების თვისებებზე. თუ R ჯგუფი განიზიდავს ელექტრონებს მაშინ ისინი ამცირებენ დადებით მუხტს კარბოქსილის ნახშირბადატომზე, რაც ასუსტებს კარბონმჟავის მჟავურ ბუნებას. რაც უფრო დიდია
- 8. -8- ალკილის ჯგუფი, მით უფრო ძლიერია ელექტრონის განზიდვის უნარი და მით უფრო სუსტია შესაბამისი კარბონმჟავა. ამიტომ ძმარმჟავა CH3COOH უფრო ძლიერი მჟავაა ვიდრე პროპიონის მჟავა H5C2COOH და ა. შ . ამავე დროს ჯგუფები რომლებიც იზიდავენ ელექტრონულ წყვილებს, აძლიერებენ მჟავურ ბუნებას. მაგ: მონოქლორძმარმჟავა ClCH2COOH უფრო ძლიერი მჟავაა ვიდრე ძმარჟავა. კიდევ უფრო ძლიერი მჟავებია დიქლორ – და ტრიქლორძმარმჟავები: Cl2CHCOOH და Cl3 CCOOH ისევე როგორც მინერალური მჟავები, ორგანული მჟავებიც რეაგირებენ მეტალებთან, ოქსიდებთან, ფუძეებთან და მარილებთან: 1. O O RC + 2Na 2 RC + H2 OH ONa 2. R C O O 2 RC + CaO Ca + H2O OH C O R ანუ (RCOO)2Ca
- 9. -9- ტრადიციულად მარილის ფორმულაში ჯერ ვწერთ მეტალის ატომს, შემდეგ მჟავას ნაშთს, მაგრამ ორგანული მჟავების მარილების ფორმულები შეიძლება პირიქით ჩავწეროთ: 3. O RC + KOH RCOOK + H2O OH 4. O RC + NaHCO3 RCOONa + H2O + CO2 OH 5. მჟავები რეაგირებენ სპირტებთან რთული ეთერების წარმოქმნით. ამ რეაქციას ეთერიფიკაციის რეაქცია ქვია: O O RC H 2 SO 4 RC + + H2O OH + H OR' OR' რთული ეთერი 6. კარბოქსილის ჯგუფის მეზობელ ნახშირბადთან მიერთებული წყალბადატომები ძალიან ადვილად შედიან ქლორირების რეაქციაში: O O Cl 2 RCH2C + RCHC + HCl OH OH Cl Cl O O Cl 2 RCHC + RCHC + HCl OH Cl OH Cl კერძო წარმომადგენლები: H-COOH ჭიანჭველმჟავა. ჭიანჭველმჟავა შედის ჭიანჭველას შხამის, ჭინჭრის და წიწვების შემადგენლობაში. მას შეიცავს ოფლი და სხვა გამონაყოფები. სხვა მჟავებისგან განსხვავებით ჭიანჭველმჟავას მოლეკულა ალდეჰიდის ჯგუფსაც შეიცავს:
- 10. - 10 - O RCOH და ყველა სხვა მჟავასგან განსხვავებით მას შეუძლია ალდეჰიდებისათვის დამახასიათებელ რეაქციებშიც შევიდეს, მაგ: O O RCOH 2O +Ag HOCOH2Ag + CO2 H2O ჭიანჭველმჟავა შეიძლება მივიღოთ ნახშირჟანგისა და ნატრიუმის ტუტის რეაგირებისას მიღებული მარილის მჟავასთან ურთიერთქმედების გზით: CO + NaOH HCOONa HCOONa + HCl HCOOH + NaCl ძმარმჟავა. ძმარმჟავა მიიღება შემდეგი გარდაქმნების გზით: O O CaO CaC2 HC≡CH CH3C CH3C H OH ძმარმჟავა მიიღება ღვინის “დაძმარებისას”. [O] H3CCH2OH CH3COOH ღვინის სპირტი ძმარმჟავა ჩვეულებრივი ღვინის ძმარი 8%-მდე ძმარმჟავას შეიცავს. ძმარმჟავა შეიძლება მივიღოთ ბუტანის დაჟანგვითაც: [O] CH3CH2CH2CH3 2CH3COOH ძმარმჟავას იყენებენ ხელოვნური ბოჭკოების, რთული ეთერების და სხვა მრავალი ქიმიური ნაერთის მისაღებად. მას მჟავე გემოს და აგრეთვე ანტისეპტიკური (ლპობის საწინააღმდეგო) თვისებების გამო იყენებენ კვების მრეწველობაში.
- 11. - 11 - უჯერი მჟავები. უჯერ მჟავებს ახასიათებთ როგორც კარბოქსილის ჯგუფის შესაბამისი, ისე ორმაგი ბმებისთვის დამახასიათებელი თვისებები. ბუნებაში ფართოდაა გავრცელებული უჯერი მჟავების ერთერთი წარმომადგენელი ოლეინის მჟავა. H3C(CH2)7CH=CH(CH2)7COOH ოლეინის მჟავა. ორფუძიანი მჟავები: უმარტივესი ორფუძიანი (ანუ კარბოქსილის ორი ჯგუფის შემცველი) მჟავაა მჟაუნმჟავა. COOH COOH სხვა ორფუძიანი მჟავებია COOH CH2 მალონმჟავა CH2COOH COOH CH2COOH ქარვის მჟავა და ა.შ. არსებობს უჯერი ორფუძიანი მჟავებიც, მაგ: CHCOOH CHCOOH მალეინის მჟავა და ა.შ. საშინაო დავალება: 1. დაწერეთ გაკვეთილში მოტანილი ძმარმჟავას მიღების სქემის შესაბამისი რეაქციების ტოლობები. 2. დაწერეთ ძმარმჟავას ურთიერთქმედების რეაქცია კალციუმთან, მაგნიუმის ოქსიდთან, ცინკის ჰიდროქსიდთან, მაგნიუმის კარბონატთან, ეთილის სპირტთან და ერთ, ორ და სამ მოლეკულა ქლორთან. 3. აკრილის მჟავა H2C=CH-COOH უჯერი მჟავაა. დაწერეთ ამ მჟავას და ნატრიუმის, კალიუმის ჰიდროქსიდის, კალციუმის კარბონატის, მეთილის სპირტის, წყალბადის, HCl ურთიერთქმედების რეაქციები (HCl
- 12. - 12 - ურთიერთქმედების პროდუქტი მარკოვნიკოვის წესის საწინააღმდეგო მიმართულებით მიიღება). 4. დაწერეთ მალონის მჟავას ურთიერთქმედება ნატრიუმთან, კალიუმის ოქსიდთან, ნატრიუმის ჰიდროქსიდთან და ერთ და ორ მოლეკულა მეთილის სპირტთან. 5. დაადგინეთ ერთფუძიანი მჟავას ფორმულა თუ მჟავას 10გ ჭარბ ნატრიუმთან გამოყოფს 1,27ლ წყალბადს (ნ.პ.). მჟავას ნორმალური აღნაგობა აქვს. 6. 20,8გ ორფუძიანი მჟავას განეიტრალებას 16გ NaOH სჭირდება. დაადგინეთ მჟავას ფორმულა.