Chapitre ii
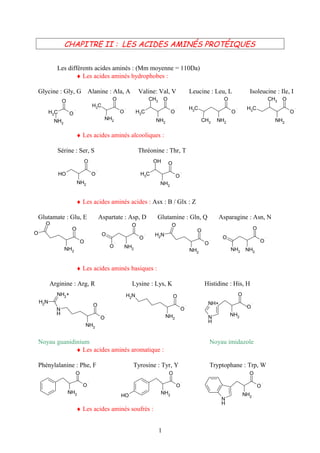
- 1. CHAPITRE II : LES ACIDES AMINÉS PROTÉIQUES Les différents acides aminés : (Mm moyenne = 110Da) ♦ Les acides aminés hydrophobes : Glycine : Gly, G Alanine : Ala, A Valine: Val, V Leucine : Leu, L Isoleucine : Ile, I O O CH3 O O CH3 O H3C H3C H3C H2C O O H3C O O O NH2 NH2 NH2 CH3 NH2 NH2 ♦ Les acides aminés alcooliques : Sérine : Ser, S Thréonine : Thr, T O OH O HO O H3C O NH2 NH2 ♦ Les acides aminés acides : Asx : B / Glx : Z Glutamate : Glu, E Aspartate : Asp, D Glutamine : Gln, Q Asparagine : Asn, N O O O O O O O O H2N O O O O O O NH2 NH2 NH2 NH2 NH2 ♦ Les acides aminés basiques : Arginine : Arg, R Lysine : Lys, K Histidine : His, H NH2+ H2N O O H2N NH+ O O N O H NH2 O NH2 N H NH2 Noyau guanidinium Noyau imidazole ♦ Les acides aminés aromatique : Phénylalanine : Phe, F Tyrosine : Tyr, Y Tryptophane : Trp, W O O O O O O NH2 NH2 NH2 HO N H ♦ Les acides aminés soufrés : 1
- 2. Méthionine : Met, M Cystéine : Cys, C O O S H3C O HS O NH2 NH2 ♦ L’iminoacide : Proline : Pro, P O O NH Quelques acides aminés particuliers : Histamine Dopamine Ornithine Citrulline O NH+ HO O H2N H2N O NH2 NH2 O N N HO H H NH2 O NN2 La stéréochimie : Chaque acide aminé possède au moins un carbone asymétrique (sauf la thréonine et l’isoleucine qui en ont deux et la glycine qui n’en possède pas). Chaque acide aminé est classé dans le système R/S : tous les acides aminés sont de la série S, sauf la cystéine qui est de la série R. Cas particulier : 2S 3R T et 2S 3S I coo- Isomère L : (dans les protéines) H3N C H coo- R Isomère D : C NH3 H R Chaque acide aminé dévie le plan de polarisation : de façon lévogyre (à gauche) et de façon dextrogyre (à droite). Les propriétés physico-chimiques : 2
- 3. Les propriétés ioniques : Chaque acide aminé libre possède au moins deux groupements fonctionnels et peut posséder d’autres fonctions sur les chaînes latérales (R). R R R H3N+ CH COOH H3N+ H2N CH COO- CH COO- pK= 2-3 pK= 9-10 Les acides aminés portant des groupements fonctionnels sur les chaînes latérales possèdent d’autre pK : (ces pK varient si l’acide aminé se trouve à l’intérieur ou à l’extérieur de la protéine). Glu et Asp : pK= 4 Lys : pK= 11 Arg : pK= 13 His : pK= 6 Tyr : pK= 10 Cys : pK= 9-10 Les propriétés optiques : ABSORPTION : (UV, Visible) Tryptophane (eau, pH 7) : λ = 280 nm ; ε = 5600 M-1.cm-1 Tyrosine (eau, pH 7) : λ = 274 nm ; ε = 1400 M-1.cm-1 Phénylalanine (eau, pH 7) : λ = 257 nm ; ε = 200 M-1.cm-1 Globalement, les protéines absorbent à 280 nm (c’est la longueur d’onde utilisée pour les dosages de protéines). Le coeff. d’extinction moléculaire (ε) varie en fonction du nombre de tryptophane dans la molécule. Les protéines absorbent à trois λ différentes : λ = 200 nm ⇒ les liaisons peptidiques λ = 280 nm ⇒ les tryptophanes λ = 500 à 600 nm ⇒ les groupements héminiques (protéines pigmentées). FLUORESCENCE : 3
- 4. Tryptophane (eau, pH 7) : λ = 348 nm ; Φ = 0.2 Tyrosine (eau, pH 7) : λ = 303 nm ; Φ = 0.14 Phénylalanine (eau, pH 7) : λ = 282 nm ; Φ = 0.04 Le rendement quantique (Φ) c’est : l’énergie émise par fluorescence / l’énergie absorbée au cours de l’excitation. La fluorescence des protéines dépend de leur composition en acides aminés, de ce fait, on peut suivre la dénaturation des protéines par mesure de fluorescence (généralement la fluorescence augmente avec la dénaturation car les acides aminés aromatiques qui se trouvaient à l’intérieur de la protéine se retrouve à l’extérieure). Les propriétés chimiques dues au groupements aminés : Les réactions d’alkylation : (R–X) R’–X + NH2 CH COO- → R' NH CH COO- + X- + H+ R R Les réactions d’acylation : (R–CO–X) R' C X + NH2 CH COO- → R' C NH CH COO- + X- + H+ O R R O 4
- 5. Les réactions avec les aldéhydes ou les cétones aromatiques : LES BASES DE SCHIFF : O aldimine Ar C + H2N CH COO- Ar CH N CH COO- + OH- OH2 + Ar CH N C COO- OH2 H R R R R + + H + OH2 Ar CH- N C COO- Ar CH2 N C COO- Ar CH2 NH2 + O C COO- R R cétimine Les enzymes qui font des bases de Schiff utilise le phosphate de pyridoxal comme coenzyme. H O O C O P O H2C OH O + N CH3 H Ce dernier se lie de façon covalente à l’enzyme par l’intermédiaire d’une base de Schiff. C’est le cas des réactions de transamination : COO- COO- COO- COO- (CH2)2 CH2 (CH2)2 CH2 + + CH C CH C H2N O O H2N COO- COO- COO- COO- LA REACTION A LA NINHYDRINE: O O O O OH NH2 H O N CH COO- N C OH + R CH COO- OH2 R CO2 R O O O O gemdiol cétimine aldimine O O O OH2 NH2 N R-CH=O + Ninhydrine O O O intermédiaire aminé pourpre de Ruheman Les propriétés chimiques dues aux groupements carboxyliques : 5
- 6. La formation d’ester : (grâce au diazométhane CH2=N+=N-) CH2=N+=N- + - OOC–R → CH3–O–CO–R Les propriétés chimiques dues aux groupements carboxyliques : LA REACTION AVEC L’ISOTHIOCYANATE DE PHENYL : R COO- CH H H R S N NH + N R C + H2N CH COO- C + H N S NH S O Isothiocyanate de phenyl Phenyl thiohydantoïne PTH + AA LA FORMATION DE CHELATE : (complexe avec des ions métalliques) O O O O C C C’est le principe du dosage du CH2 CH2 biuret Cu++ NH NH où les peptides réagissent avec les C O C O ions H2O CH2 CH2 Cu++ cuivre pour donner une coloration bleue NH2 NH2 H2O dosable à 540 nm. Les propriétés chimiques dues aux chaînes latérales: AVEC LES FONCTIONS AMINES : (avec le N-hydroxy succinimide) OH O OH N O O O O N N O + P-NH2 O O + R1 P R1 NH O Cette technique permet de marquer l’extrémité N terminale des peptides, grâce à un marquage du groupement R1 : exemple de l’iodination : réactif de Bolton Hunter O SO3Na O N O CH2 CH2 I125 O OH I125 N N AVEC LES FONCTIONS ACIDES : (avec les carbodiimides) DCCD 6
- 7. NR1 R NHR1 R'-NH2 R R' C NHR1 R-COOH + O C N H + O C NR2 O NR2 O NHR2 AVEC LES GROUPEMENTS THIOLS : ox R–CH2–SH + HS–CH2–R R–CH2–S–S–CH2–R red Cas du glutathion (γ glutamylcysteinylglycine) : le rapport GSH / GSSG détermine la formation des pont dissulfure dans le milieu intracellulaire. GSH = H3N+ CH (CH2)2 CONH CH CONH CH2 COOH COOH CH2 SH Glutathion réductase GSSG + NADPH + H+ 2 GSH + NADP+ P GSSG + HS–P–SH 2 GSH + S S En solution aqueuse, il y’a oxydation spontanée et formation de ponts dissulfures n’existant pas dans les protéines natives. De ce fait on ajoute des agents réducteurs dans le tampon pour éviter ce phénomène. Le β mercaptoéthanol : HS–(CH2)2–OH (il faut deux molécules de β mercaptoéthanol pour réduire un pont dissulfure). Le dithiothréitol (DTT) : HO SH SH HO Le blocage des fonctions thiols est également nécessaire pour que les ponts dissulfures ne se reforment pas, ce blocage est réalisé de deux façons : La S Carboxylation : (avec l’iodoacétate : ICH2COO- ) R CH2 S + ICH2COO- I + R CH2 S CH2COO- La Cyanoéthylation : (avec CH2=CH-CN ) R CH2 SH + CH2CHCN R CH2 S (CH2)2 CN Le dosage des cystéines et des ponts dissulfures : + + H 1) R CH2 SH + Hg COO- R CH2 S Hg COO- Paramercuribenzoate Coloration rouge 7
- 8. 2) méthode d’ELLMAN (dosage des R-S- libre) RS- + N2O S S N2O R S N2O + S N2O COO- COO- COO- COO- DTNB-- TNB-- (coloration jaune) AVEC LES ACIDES AMINES AROMATIQUES : La réaction de iodination des tyrosines : I Péroxydase R OH + 2 I + H2O2 R OH + 2 OH2 I Les réactions de modification des tryptophanes : H2 H2 C R C R +O N O pH = 5 N N O H Br H Indole Oxindole H N CHO + O3 H2 C R O N Formyl Kynuréine (plus de fluorescence) La liaison peptidique : structure et propriétés ; principaux peptides d’intérêt biologique. Les acides aminés sont reliés entre eux par l’intermédiaire de liaison peptidique : R R R O R H2N C COO- + H2N C COO- H2N C N C COO- + OH2 H H 8 H H H
- 9. L’enchaînement des acides aminés selon les liaisons peptidiques (sans tenir comptes des chaînes latérales) s’appelle la chaîne principale. Les acides aminés se polymérisent, pour former des peptides : 2 acides aminés = dipeptides 3 acides aminés = tripeptides 30 acides aminés = polypeptides 50 acides aminés = protéines (peut contenir jusqu’à 40000 acides aminés) Les peptides d’intérêt biologiques sont très nombreux, les principaux sont les enzymes, les transporteurs de métabolites, les récepteurs, les hormones et facteurs de croissance, les protéines de structure, du cytosquelette, régulatrice, de stockage,…. Structure primaire des peptides et des protéines ; séquençage. La chaîne polypeptidique doit alors s’organiser pour être fonctionnelle, elle doit se replier (Folding : Repliement). Il existe quatre niveaux de repliement : La structure primaire : la séquence en acides aminés. La structure secondaire : l’organisation de la chaîne principale en motifs structuraux. La structure tertiaire : position dans l’espace de l’ensemble des atomes de la protéine (il y a une seule chaîne polypeptidique). La structure quaternaire : il y a plusieurs chaînes polypeptidiques associées entre elles par des liaisons non covalentes. L’enchaînement des acides aminés se fait de l’extrémité N ter vers l’extrémité C ter. Le séquençage des protéines doit toujours commencer par l’action d’agents réducteurs ( β mercaptoéthanol ou DTT ) suivi de l’action des agents bloquant les résidus SH libres ( Cyanoéthylation ou S Carboxylation) ou de l’action de l’acide performique (O=CH- OOH) qui oxyde les SH libre en résidus SO 3-. Ces mesures permettent de linéariser la ou les chaînes polypeptidiques en coupant les ponts inter ou intra-chaîne, ainsi on peut isoler s’il le faut chaque chaîne par électrophorèse et les séquencer séparément. Par la suite on travaillera donc sur des chaînes peptidiques ne possédant qu’une extrémité N ter et qu’une extrémité C ter. Les peptides ainsi linéarisés sont ensuite coupé en plus petits peptides afin de suivre le séquençage de façon plus simple. La chaîne polypeptidique peut être coupée de deux façons : La coupure chimique : (deux exemples) Avec le bromure de cyanogène au niveau des méthionines: CH3 CH3 + S S Br H2 H2 R (CH2)2 OH2 C C (CH2)2 + Br N C + H2N C N C CO N N Br N C CO N H H H + H H O H H H H 9 O lactone
- 10. Avec l’acide acétique glacial entre les aspartates et les prolines. La coupure enzymatique : Il existe deux types d’enzymes (qu’elles soient naturelles ou synthétiques) : les endoprotéases et les exoprotéases. Les exoprotéases coupent les acides aminés terminaux, tandis que les endoprotéases coupent à l’intérieure des chaînes polypeptidiques. Ensuite on peut encore diviser les exoprotéases en deux sortes de sous enzymes : les carboxypeptidases qui coupent du côté carboxy terminal (COO-) de l’acide aminé et les aminopeptidases qui coupent du côté amino terminal (NH2) de l’acide aminé. Voici quelques exemples d’enzymes : Les endoprotéases : Nom Provenance Acides aminés Côté de la coupure Pepsine Suc gastrique L,M,F,Y,W amino Trypsine Suc pancréatique K,R carboxy Chymotrypsine Suc pancréatique F,Y,W carboxy Les exoprotéases : Nom Provenance Acides aminés Côté de la coupure Carboxypeptidase A Suc pancréatique ≠ K,R,P carboxy terminal Carboxypeptidase B Suc pancréatique K,R carboxy terminal Il existe également des protéases synthétiques (AspC, LysC,…), cependant, ces enzymes coûtent très chères. Si l’on veut modifier l’action des endoprotéases, on doit modifier les acides aminés de part et d’autre de la liaison peptidique : exemple de la lysine : O O O CH3 R (CH2)4 NH2 + R (CH2)4 NHCO C H CH3 COO- anhydride cytraconique Ainsi, la lysine n’est plus reconnu par la trypsine. Analyse des mélanges de peptides : On fait une séparation par chromatographie en phase inversée (RP-HPLC) : Phase stationnaire : hydrophobe ( silice + chaîne aliphatique : bras mobile) Phase mobile : solvant de polarité décroissante : (eau ; 0 à 90% d’acétonytrile :CH3CN). 10
- 11. La solution contenant les peptides se fixe à la phase stationnaire par interaction hydrophobe. On peut également faire une électrophorèse suivie d’un transfert sur papier PVDF ou sur nitrocellulose. Les taches obtenues sont déposées dans l’analyseur d’EDMAN, afin de connaître le nom du ou des acides aminés correspondants. La réaction d’EDMAN : (réaction récurrente jusqu’à 50 acides aminés) 1) Couplage en milieu alcalin : S H H N N C S + H2N C CO N C H H H H R1 R2 N C CO N C H H R1 R2 2) Clivage : S O H S O H N N C N H N C H H N C + H2N C CO H H R1 R2 H+ (milieu anhydre) H H R1 R2 anilinothiazolinone (milieu acide) 3) Conversion : S S O + S N H H NH H N C + OH2 N H N C COOH H N + OH2 H H R1 R1 H O R1 Ensuite chaque phényl thiohydantoïne est analysé puis identifié par chromatographie, phényl thiohydantoine car chacun d’entre eux possède son propre pic. Analyse des extrémités C ter et N ter : N ter : chimique (méthode de SANGER) H H R-X + H2N C R N C CO analyse seulement du premier acide aminé H réactif coloré R1 R1 hydrolyse des liaisons peptidiques enzymatique (avec les aminopeptidases) C ter : chimique (hydrazonolyse : NH2-NH2) H H H2N C CO + H2N NH2 H2N C CO N NH2 H R1 R1 Acides aminés n à n-1 (pas n) enzymatique (avec les carboxypeptidase) Le séquençage peut également être réalisé par spectrométrie de masse : • MALDI : Maldi Assisted Laser Desorption Ionisation Permet de déterminer la masse molaire et la séquence, directement sur la protéine entière. • ESMS : (électrospray) 11
- 12. Permet de déterminer la masse molaire et la séquence, directement sur la protéine native. 12
- 13. Permet de déterminer la masse molaire et la séquence, directement sur la protéine native. 12
- 14. Permet de déterminer la masse molaire et la séquence, directement sur la protéine native. 12
- 15. Permet de déterminer la masse molaire et la séquence, directement sur la protéine native. 12