Teoria atômica e tabela periódica
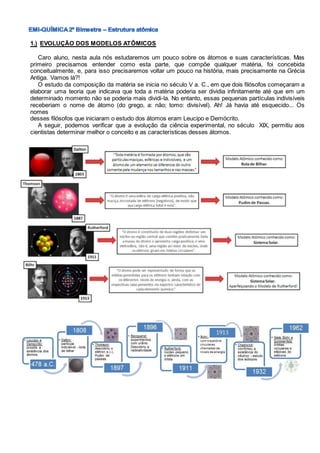
- 1. 1.) EVOLUÇÃO DOS MODELOS ATÔMICOS Caro aluno, nesta aula nós estudaremos um pouco sobre os átomos e suas características. Mas primeiro precisamos entender como esta parte, que compõe qualquer matéria, foi concebida conceitualmente, e, para isso precisaremos voltar um pouco na história, mais precisamente na Grécia Antiga. Vamos lá?! O estudo da composição da matéria se inicia no século V a. C., em que dois filósofos começaram a elaborar uma teoria que indicava que toda a matéria poderia ser dividia infinitamente até que em um determinado momento não se poderia mais dividi-la. No entanto, essas pequenas partículas indivisíveis receberiam o nome de átomo (do grego, a: não; tomo: divisível). Ah! Já havia até esquecido... Os nomes desses filósofos que iniciaram o estudo dos átomos eram Leucipo e Demócrito. A seguir, podemos verificar que a evolução da ciência experimental, no século XIX, permitiu aos cientistas determinar melhor o conceito e as características desses átomos.
- 2. O modelo que utilizaremos em nossos estudos por aqui é o de Rutherford-Böhr, nele existem duas regiões distintas: o núcleo o, onde estão os prótons (partículas de carga positiva) e os nêutrons (partículas de sem carga); e a eletrosfera a, onde se encontram os elétrons (partículas de carga negativa). Ao tomarmos esse modelo atômico de Rutherford-Böhr como uma referência, podemos definir alguns conceitos básicos: Número Atômico (Z): refere-se à quantidade de prótons (p) no núcleo de um átomo. Sendo assim, esse número atômico é quem caracteriza um elemento químico; Número de Massa (A): refere-se a soma dos prótons (p) e nêutrons (n) do núcleo de um átomo, pois estas são as únicas partículas que possuem uma massa relativamente considerável no átomo. Nesta última fórmula o “p” foi substituído por “Z”, porque já vimos no conceito de Número Atômico que seus valores são iguais, Z = p. Logo, não faria diferença, ainda que conceitual, em utilizar uma dessas duas letras. Elemento químico: é o conjunto formado por átomos de mesmo número atômico (Z).
- 3. Íon: a espécie química que apresenta o número de prótons diferente do número de elétrons. • íons positivos = cátions • íons negativos = ânions 2.) SEMELHANÇAS ATÔMICAS Isótopos: são átomos que apresentam o mesmo número atômico (Z), por pertencerem ao mesmo elemento químico, mas diferentes números de massa (A). Isóbaros: são átomos que apresentam diferentes números atômicos (Z), mas mesmo número de massa (A). Isótonos: são átomos que apresentam o mesmo número de nêutrons (n), mas diferentes números atômicos (Z) e de massa (A). Isoeletrônicos: átomos e íons que apresentam a mesma quantidade de elétrons.
- 4. 3.) ESTUDO DO MODELO ATUAL O elétron move-se em orbitas em torno do núcleo; A energia total do elétron é representada em valores multiplos de um quantun. Elétrons não emitem energia em sua orbita; Quando um átomo passa para outra orbita, emite ou absorve energia, definida como quantum de energia. 4.) NÍVEIS E SUBNÍVEIS DE ENERGIA Segundo Linus Pauling cada orbital pode acomodar um máximo de elétrons. Em átomos mutieletrônicos os elétrons estão dispostos segundo um diagrama de energia proposto por Pauling. De cima para baixo, temos os níveis de energia em ordem crescente, representada pelos números de 1 a 7. Os subníveis de cada nível são representados pelas letras s, p, d e f. Usando o diagrama: distribuição eletrônica 1H= 1s1 2He= 1s2 4Be= 1s2 , 2s2 26Fe= 1s2 , 2s2 , 2p6 , 3s2 , 3p6 , 4s2 , 3d6 distribuição por camada: 2 – 8 – 14 – 2
- 5. Usando o diagrama: distribuição eletrônica em íons átomo: 17Cl = 1s2 , 2s2 , 2p6 , 3s2 , 3p5 distribuição por camada: 2 – 8 – 7 íon: 17Cl -1 = 1s2 , 2s2 , 2p6 , 3s2 , 3p6 distribuição por camada: 2 – 8 – 8 átomo: 11Na = 1s2 , 2s2 , 2p6 , 3s1 distribuição por camada: 2 – 8 – 1 íon: 11Na+1 = 1s2 , 2s2 , 2p6 distribuição por camada: 2 – 8 5.) CONEXÃO PERIÓDICA Estudamos na aula anterior como os elétrons se distribuem na eletrosfera atômica, por agora estabeleceremos algumas conexões entre essas distribuições e a Tabela Periódica. A estrutura da tabela periódica dispõe seus elementos químicos em ordem crescente de número atômico, organizado em períodos, como linha horizontal, e famílias ou grupos, em colunas verticais. E, através dessa organização, podemos realizar algumas previsões no que diz respeito às propriedades dos elementos químicos. Tais como, tamanhos dos átomos, tipos de ligações que possivelmente realizarão e a distribuição eletrônica. Sendo todas essas previsões confirmadas por meio da experimentação. De acordo com a União Internacional de Química Pura e Aplicada (IUPAC), os, aproximadamente, 118 elementos químicos estão organizados em colunas verticais (famílias) e horizontais (períodos) como mostra a imagem a seguir:
- 6. Períodos: são cada uma das linhas horizontais, em um total de 7 períodos. Sendo o número do período correspondente ao número de camadas ou níveis eletrônicos em que os elementos químicos se encontram. Vejamos: 11Na - 1s2 2s2 2p6 3s1 → K = 2e- | L = 8e- | M = 1e- → Possuindo 3 camadas, o sódio (Na) se encontra no 3º período, ou seja, na terceira linha da tabela periódica. 52Sb - 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4f14 5p3 → K = 2e- | L = 8e- | M = 18e- | N = 32e- | N = 5e- → Possuindo 5 camadas, o antimônio (Sb) se encontra no 5º período, ou seja, na quinta linha da tabela periódica.
- 7. 6.) TESTE SUAS HABILIDADES 1. O primeiro modelo científico para o átomo foi proposto por Dalton, em 1808. Esse modelo poderia ser comparado com: a) uma bola de tênis. b) uma bola de futebol. c) uma bola de pingue-pongue. d) uma bola de bilhar. e) uma bexiga cheia de ar. 2. Relacione os nomes dos cientistas às alternativas a seguir: • Demócrito • Thomson • Rutherford • Dalton • Chadwick a) É o descobridor do nêutron. b) Seu modelo atômico era semelhante a uma bola de bilhar. c) Seu modelo atômico era semelhante a um pudim de passas. d) Foi o primeiro a utilizar a palavra átomo. e) Criou um modelo para o átomo semelhante ao sistema solar. 3. O elétron foi descoberto por Thomson no final do século XIX. Quais as características gerais do modelo atômico proposto por ele? 4. Faça uma crítica à afirmação: “O modelo atômico clássico criado por Rutherford, em 1911, é considerado o modelo definitivo para o átomo.” 5. Indique o número de prótons, nêutrons e elétrons presentes em cada átomo dos seguintes elementos: 6. Considere a representação: O átomo assim representado apresenta quanto(as): a) prótons? b) nêutrons? c) elétrons? d) partículas nucleares? e) partículas na parte periférica do átomo? f) partículas com carga elétrica positiva? g) partículas com carga elétrica negativa? h) partículas sem massa? i) partículas fundamentais que formam um átomo deste elemento? 7. Um dos principais poluentes atmosféricos é o monóxido de carbono (CO). Determine o número de prótons, nêutrons e elétrons existentes em uma molécula desse poluente. Dados: C (Z = 6) (A = 12); O (Z = 8) (A = 16) 8. Faça a distribuição eletrônica dos átomos abaixo e mostre sua distribuição em camadas: a.) 16S b.) 56Ba c.) 6C
- 8. d.) 7N e.) 8O f.) 16S-2 g.) 7N+3 h.) 8O+3 9. Considere um determinado elemento químico cujo subnível mais energético é o 5s2 . Qual o número de elétrons que ele possui e qual o número atômico desse elemento? 10. O argônio é um gás nobre que apresenta número atômico igual a 18. Quantas camadas eletrônicas ele apresenta e quantos elétrons possui em cada uma dessas camadas? 11. De acordo com o ‘princípio de Aufbau’ para a distribuição eletrônica em átomos multieletônicos, diz- se que um átomo encontra-se em um estado fundamental quando seus elétrons se localizam nos estados de menor energia. Dentre as opções de distribuição representadas abaixo, diga qual delas representa a distribuição de um átomo em seu estado fundamental. a.) 1s² 2s² 2p² b.) 1s² 2s² 2p6 3s² 3p⁶ 4s² 3d¹° c.) 1s² 2s² 2p6 3s1 d.) 1s² 2s² 2p6 3s² 12. A representação a seguir corresponde à parte superior da tabela periódica, na qual as letras não correspondem aos verdadeiros símbolos dos elementos. Com base na tabela, responda às questões de 1 a 8: a) Indique o calcogênio de maior número atômico. b) Identifique o metal alcalino de menor número atômico. c) Qual elemento apresenta a configuração 2s2 2p3 na camada de valência? d) Escreva a configuração eletrônica, em subníveis, da camada de valência do elemento E. e) Qual elemento apresenta propriedades químicas semelhantes ao elemento P? f) Indique o elemento de transição de menor número atômico. g) Identifique o estado físico dos elementos D e T a 25 ºC e a 1 atm. h) Quais são os números atômicos dos elementos R e C? i) O termo halogênio significa formador de sal. A configuração eletrônica da camada de valência desses elementos pode ser representada por nsx npy .Os valores corretos de x e y são: a)2 e 5. b) 2 e 6. c) 2 e 4. d) 1 e 7. e) 2 e 7.