Propriedades dos elementos e tabela periódica
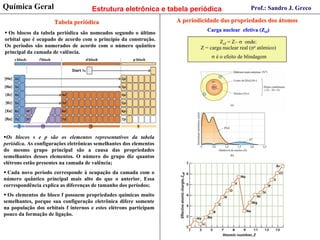
- 1. Química Geral Prof.: Sandro J. Greco Estrutura eletrônica e tabela periódica A periodicidade das propriedades dos átomos Tabela periódica Carga nuclear efetiva (Zef) Os blocos da tabela periódica são nomeados segundo o último orbital que é ocupado de acordo com o princípio da construção. Zef = Z– σ onde: Os períodos são numerados de acordo com o número quântico Z = carga nuclear real (no atômico) principal da camada de valência. σ é o efeito de blindagem Os blocos s e p são os elementos representativos da tabela periódica. As configurações eletrônicas semelhantes dos elementos do mesmo grupo principal são a causa das propriedades semelhantes desses elementos. O número do grupo diz quantos elétrons estão presentes na camada de valência; Cada novo período corresponde à ocupação da camada com o número quântico principal mais alto do que o anterior. Essa correspondência explica as diferenças de tamanho dos períodos; Os elementos do bloco f possuem propriedades químicas muito semelhantes, porque sua configuração eletrônica difere somente na população dos orbitais f internos e estes elétrons participam pouco da formação de ligação.
- 2. Química Geral Prof.: Sandro J. Greco Estrutura eletrônica e tabela periódica Raio atômico Periodicidade do raio atômico Raio atômico de um elemento é definido como sendo a metade da distância entre os centros de átomos vizinhos. Se o elemento é um metal, o raio atômico é a metade da distância entre os centros de átomos vizinhos em uma amostra sólida; Se o elemento é um não metal ou um metalóide, usa-se a distância entre os núcleos de átomos unidos por uma ligação química – raio covalente; Os raios atômicos geralmente decrescem da esquerda para a direita Se o elemento é um gás nobre usa-se o raio de Van der Waals, em cada período devido ao aumento da carga nuclear efetiva, e que é a metade da distância entre os centros de átomos vizinhos crescem em cada grupo quando camadas sucessivas são ocupadas. em uma amostra do gás sólido; Raio iônico O raio de Van der Waals é sempre muito maior do que o raio covalente. Raio iônico de um elemento é a sua parte da distância entre íons vizinhos em um sólido iônico. Em outras palavras, a distância entre os centros de um cátion e um ânion vizinhos é a soma dos dois raios iônicos.
- 3. Química Geral Prof.: Sandro J. Greco Estrutura eletrônica e tabela periódica Tendências de periodicidade dos raios iônicos Energia de ionização (I) ionizaç É a energia necessária para remover um elétron de um átomo na fase gasosa. X+(g) + e-(g) I = E(X+) – E(X) X(g) Cu+(g) + e-(g) I 1= 8,14 eV, 785 kJ . Mol-1 Cu(g) Cu+(g) Cu2+(g) + e-(g) I 2= 20,26 eV, 1995 kJ . Mol-1 I1 < I2 < I3 … Os raios iônicos geralmente crescem com o valor de n em um grupo e decrescem da esquerda para a direita em um período. Os cátions são menores e os ânions são maiores do que os átomos originais. Os cátions são menores o que os átomos originais pois para formá- lo, os átomos perdem um ou mais elétrons expondo o seu caroço menor. Já o ânion é maior devido ao aumento da repulsão eletrônica.
- 4. Química Geral Prof.: Sandro J. Greco Estrutura eletrônica e tabela periódica Exceções da energia de ionização Exceç ionizaç A primeira energia de ionização geralmente decresce em um grupo. Com poucas exceções a primeira energia de ionização aumenta da esquerda para a direita no período e cai para valores mais baixos no início do período seguinte. • Os elétrons s são mais eficazes na proteção do que os elétrons p. Conseqüentemente, a formação de s2p0 se torna mais favorável. • Quando um segundo elétron é colocado em um orbital p, aumenta a repulsão elétron-elétron. Quando esse elétron é removido, a configuração s2p3 resultante é mais estável do que a configuração inicial s2p4. Portanto, há uma diminuição na energia de ionização. • O elétron mais externo é mais facilmente removido ao Configurações eletrônicas de íons Configuraç descermos em um grupo. À medida que o átomo aumenta, torna- se mais fácil remover um elétron do orbital mais volumoso. • Cátions: os elétrons são primeiramente removidos do orbital com o maior número quântico principal, n: • Geralmente a energia de ionização aumenda ao longo do período. Ao longo de um período, Zef aumenta. Li (1s2 2s1) → Li+ (1s2) Consequentemente, fica mais difícil remover um elétron. Fe ([Ar]3d6 4s2) → Fe3+ ([Ar]3d5) • Existem duas exceções: a remoção do primeiro elétron p e a •Ânions: os elétrons são adicionados ao orbital com o mais baixo remoção do quarto elétron p. valor de n disponível: F (1s2 2s2 2p5) → F- (1s2 2s2 2p6)
- 5. Química Geral Prof.: Sandro J. Greco Estrutura eletrônica e tabela periódica Afinidade Eletrônica Eae Efeito do par inerte Efeito do par inerte é a tendência a íons com carga duas A afinidade eletrônica de um elemento é a energia liberada unidades mais baixa do que a esperada para o número do grupo . quando um elétron se liga a um átomo na fase gasosa . Grupo 13/III – Al → Al+3, In → In3+ e In+ X(g) + e-(g) → X- (g) Eae= E(X) – E(X-) Grupo 14/IV – Sn → Sn4+, Pb → Pb+2 Cl(g) + e-(g) → Cl- (g) Eae= 3,62 eV, 349 kJ . Mol-1 Al – [Ne]3s2 3p1, In – [Kr]4d10 5s2 5p1 Sn – [Kr]4d105s25p2, Pb – [Xe]4f145d106s26p1 A afinidade eletrônica é muito menos periódica do que o raio atômico e a energia de ionização. Entretanto, uma tendência é claramente visível, as afinidades eletrônicas são maiores na parte superior direita da tabela periódica O efeito do par inerte é devido, em parte, às energias relativas dos Cuidado!!!! Os valores positivos da afinidade eletrônica dizem que elétrons de valência s e p. Nos períodos mais tardios da tabela após a adição do elétron a energia é liberada. Para valores positivos, periódica, os elétrons de valência s tem energia muito baixa por faz-se necessário energia para adicionar o elétron ao elemento. Em causa da sua boa penetração e da baixa capacidade de blindagem alguns livros esses sinais são invertidos, pois referem-se a valores de dos elétrons d. Portanto eles podem permanecer ligados ao átomo entalpia. durante o processo de ionização.
- 6. Química Geral Prof.: Sandro J. Greco Estrutura eletrônica e tabela periódica Relações diagonais Relaç Exemplo de relação diagonal relaç As relações diagonais são semelhanças de propriedades entre vizinhos diagonais nos grupos principais da tabela periódica. O boro (acima) e o silício (abaixo), possuem uma relação diagonal. Ambos são sólidos brilhantes, com alto ponto de fusão. Possuem ainda várias semelhanças químicas. Elementos dos grupos principais A relação diagonal deve-se em parte às características de raio atômico e energia de ionização desses elementos.
- 7. Química Geral Prof.: Sandro J. Greco Estrutura eletrônica e tabela periódica Características dos metais e não-metais Caracterí não- Elementos do grupo 14/IV. Da esquerda para a direita: carbono (como grafita), silício, germânio, estanho e chumbo. Os elementos do bloco p, localizados a esquerda, principalmente os mais pesados, possuem energias de ionização baixas o suficiente, para que eles tenham algumas propriedades metálicas dos elementos do bloco s. Contudo, suas energias de ionização são muito mais elevadas por isso são menos reativos do que os elementos do bloco s. Elementos do grupo 16/VI. Da esquerda para a direita: Oxigênio, enxofre, selênio e telúrio. Observe a tendência de não-metal a metalóide Metais alcalinos são macios, Os elementos do bloco p, localizados a direita tem afinidades reativos e tem cor prateada. Uma eletrônicas caracteristicamente altas: tendem a ganhar superfície recentemente cortada elétrons para completar camada. Exceto os metalóides Te e cobre-se rapidamente com o Po, os membros dos grupos 16/VI e 17/VII são não metais. óxido correspondente. Eles formam compostos moleculares entre si e reagem com metais para formar ânions em compostos iônicos.
- 8. Química Geral Prof.: Sandro J. Greco Estrutura eletrônica e tabela periódica Metais de transição transiç Todos os elementos do bloco d são metais com características intermediárias entre os elementos do bloco s e p; Como os metais de transição de um mesmo período diferem principalmente no número de elétrons d, e estão em camadas internas, sua propriedades são muito semelhantes; A maior parte dos metais do bloco d ao perderem elétrons para formar cátions o fazem no subnível s externo, entretanto, formam íons com diferentes estados de oxidação; A disponibilidade dos orbitais d dos metais de transição é em grande parte responsável pela utilização desses elementos como catalisadores na indústria química.e a semelhança do raio atômico. Elementos na primeira linha do bloco d: Acima (da esquerda para a direita): escândio, titânio, vanádio, cromo e manganês. Abaixo: ferro, cobalto, níquel, cobre e zinco.
