ATOMÍSTICA E TABELA PERIÓDICA
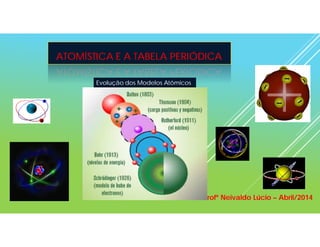
- 1. ATOMÍSTICA E A TABELA PERIÓDICA Profº Neivaldo Lúcio – Abril/2014 Evolução dos Modelos Atômicos
- 2. ESTRUTURA DO ÁTOMO Várias Interpretações do Átomo
- 3. MODELO ATÔMICO DE DALTON: o átomo é constituído de uma pequena esfera maciça indivisível e indestrutível. (bola de bilhar) MODELO ATÔMICO DE THOMSON: o átomo é constituído de uma porção material não maciça positiva na qual estão incrustados os elétrons de carga negativa para neutralizar e estabilizar a massa positiva. (pudim com passas)
- 4. MODELO ATÔMICO DE RUTHERFORD - BOHR: o átomo é constituído de uma região central pequena, densa e carregada positivamente chamada de núcleo, em volta da qual estão circulando os elétrons em órbitas estacionarias, circulares e concêntricas, sem perder energia na forma de ondas eletromagnéticas. (LUZ) - Modelo Planetário Camadas eletrônicas (nível de energia) núcleo
- 5. Obs1. Os elétrons só podem percorrer determinadas órbitas, não perdendo energia na forma de ondas eletromagnéticas nessas órbitas. Obs2. Os elétrons só podem ganhar ou perder energia quando passam de uma orbita para outra. Obs3. O elétron ganha energia quando passa de uma órbita interna para uma órbita externa e perde energia quando passa de uma órbita externa para uma órbita interna. (Onda Eletromagnética – LUZ)
- 6. MASSA CARGA DESCOBRIDOR PRÓTON 1 +1 GOLDSTEIN NÊUTRON 1 0 CHADWICK ELÉTRON 1 / 1836 - 1 THONSOM
- 7. ESTUDO DO NÚCLEO NÚMERO DE PRÓTONS: Indica a quantidade de prótons existente no núcleo atômico. (cargas positivas) NÚMERO DE NÊUTRONS: Indica a quantidade de nêutrons existente no núcleo atômico. (partículas sem cargas) NÚMERO DE MASSA: Indica a quantidade total de nucleontes ( prótons e nêutrons ) existente no núcleo atômico. (cargas negativas) [ A = P + N ].
- 8. ISOTOPIA: é o fenômeno onde os átomos apresentam o mesmo número de prótons e diferente número de massa. Sendo os átomos chamados de isótopos. ISOTONIA: é o fenômeno onde os átomos apresentam o mesmo número de nêutrons e diferente número de massa. Sendo os átomos chamados de isótonos ISOBARIA: é o fenômeno onde os átomos apresentam o mesmo número de massa e diferente número de prótons. Sendo os átomos chamados de isóbaros. ISOELETRÔNICOS: são espécies químicas (átomos e íons) que apresentam o mesmo número de elétrons. Características dos Átomos
- 11. ÁTOMO: é a menor porção de um elemento químico que conserva as propriedades do elemento. ELEMENTO QUÍMICO: é um conjunto de átomos que apresentam o mesmo número atômico. ÁTOMO eletricamente estabilizado: É um sistema neutro onde o número de prótons é igual ao número de elétrons. Conceitos Básicos do Estudo do Átomo
- 12. ÍON: É toda espécie química dotada de carga, onde o número de prótons é diferente do número de elétrons. CÁTION: É todo íon de carga positiva, onde o número de prótons é maior que o número de elétrons. ÂNION: É todo íon de carga negativa, onde o número de prótons é menor que o número de elétrons
- 14. CAMADA OU NÍVEL: É a região do átomo onde o elétron se move sem perder energia , indicando a distância que o elétron se encontra do núcleo, determinando assim a energia potencial do elétron. 1. NÚMERO QUÂNTICO PRINCIPAL (n) Indica a camada em que o elétron se encontra. A Eletrosfera do Átomo
- 15. SUB-NÍVEL: Indica a forma do orbital em que o elétron se encontra, fornecendo assim o tipo de movimento do elétron, determinando então a energia cinética do elétron. NÚMERO QUÂNTICO SECUNDÁRIO OU AZIMUTAL (l) Indica a sub-nível em que o elétron se encontra: Sub-nível: s p d f valores 0 1 2 3
- 16. ORBITAL: É a região do átomo onde se tem a maior probabilidade de encontrar o elétron; 2 . O NÚMERO QUANTICO MAGNÉTICO (m) Indica o orbital em que o elétron se encontra, e a orientação espacial do orbital. Varia de acordo com a expressão: m = ( - l à + l )
- 17. NÚMERO QUÂNTICO SPIN (s) Indica o sentido de rotação do elétron.
- 18. Configuração em Sub-Nível e Orbitais 1. O primeiro elétron que entra no Sub-Nível orienta a entrada dos demais elétrons, até que se faça necessário a entrada dos elétrons no sentido contrário; 2. Regra de Hund: Em um Sub-Nível, um orbital só pode receber o seu segundo elétron, se os demais orbitais estiverem semi- preenchidos. 3. Princípio da Exclusão de Pauli: Em um orbital cabem no máximo dois elétrons de spins contrários.
- 19. • É feita na ordem crescente de energia; • O elétron irá ocupar primeiro nível e Sub-nível de menor conteúdo energético disponível; • A energia do elétron é dada pela soma (n+ l); • O elétron terá maior conteúdo energético quanto maior for a soma (n+ l); • Quando a soma (n+ l ) de dois elétrons for igual, terá maior energia aquele que apresentar maior valor de (n) • Um átomo encontra-se no estado fundamental, quando seus elétrons apresentam menor conteúdo energético possível. DISTRIBUIÇÃO ELETRÔNICA -
- 20. os diferentes níveis de energia (n), ou camadas, são representados por números (1, 2, 3, 4, 5, 6, e 7), sendo que cada número desse corresponde às camadas eletrônicas K, L, M, N, O, P e Q, respectivamente. A ordem crescente de energia dessas camadas vai da camada mais interna (K) para a camada mais externa (Q). Cada nível apresenta um ou mais subníveis (l), que são representados pelas letras s, p, d, f. Os sub- níveis em um mesmo nível apresentam energias diferentes entre si, que aumentam na seguinte ordem: s < p < d < f O primeiro nível K (n = 1) apresenta apenas um subnível, que é o s; o segundo nível L (n = 2) apresenta dois subníveis, que são o s e o p; e assim por diante, segundo mostrado no diagrama acima.
- 21. Ao fazermos a distribuição eletrônica utilizando o diagrama de Pauling, anotamos a quantidade de elétrons em cada subnível no seu lado direito superior, conforme o modelo abaixo: Um aspecto também muito importante a ser ressaltado é que nem sempre o subnível mais externo é o mais energético. Por isso, ao se realizar a distribuição eletrônica, a ordem crescente de energia que deve ser seguida é a indicada pelas setas: Distribuição eletrônica do átomo de ferro (Z = 26): Subnível mais energético “d” com 6 elétrons (penúltima camada) última camada
- 23. DISTRIBUIÇÃO ELETRÔNICA - DIAGRAMA DE LINUS PAULING Feita: a) por ordem crescente de energia: feita pela ordem das setas b) por ordem geométrica: feita pela ordem de distribuição nas camadas
- 24. Pode-se também escrever a distribuição, por extenso, em ordem geométrica (ordem crescente de n): 1s2 / 2s2 2p6 / 3s2 3p6 3d6 / 4s2 • Distribuição eletrônica do átomo de bromo (Z = 35): Escrevendo a distribuição eletrônica, por extenso, em ordem de energia (ordem das setas diagonais): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p5 Pode-se também escrever a distribuição, por extenso, em ordem geométrica (ordem crescente de n): 1s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s2 4p5 Nível mais energético: 4p5. Nível mais externo: 4p5. Nível mais energético: 4p5
- 25. Outro exemplo: Distribuição eletrônica do átomo de Tungtênio (Z = 74): Escrevendo a distribuição eletrônica, por extenso, em ordem de energia (ordem das setas diagonais): 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d4 Pode-se também escrever a distribuição, por extenso, em ordem geométrica (ordem crescente de n): 1s2 / 2s2 2p6 / 3s2 3p6 3d10 / 4s2 4p6 4d10 4f14 / 5s2 5p6 5d4 / 6s2 Nível mais energético: 5d4 Nível mais externo: 6s2
- 27. Organização: 7 períodos: linhas horizontais (corresponde ao número de camadas) 18 famílias ou grupos: colunas horizontais Elementos representativos: pertencentes aos grupos 1, 2 e dos grupos de 13 a 17. Elementos (ou metais) de transição: pertencentes aos grupos de 3 a 12 Elementos (ou metais) de transição interna: pertencentes às séries dos lantanídios e dos actinídios. Gases nobres: pertencentes ao grupo 18.
- 28. Organização das Famílias da T. P.
