Unidad 5 (2). Las enzimas
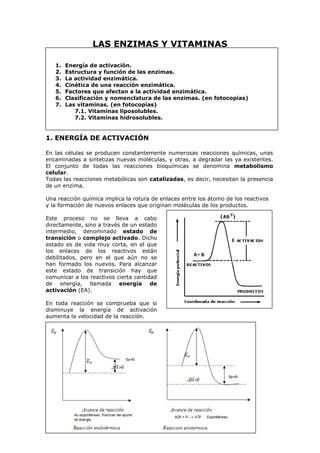
- 1. LAS ENZIMAS Y VITAMINAS 1. 2. 3. 4. 5. 6. 7. Energía de activación. Estructura y función de las enzimas. La actividad enzimática. Cinética de una reacción enzimática. Factores que afectan a la actividad enzimática. Clasificación y nomenclatura de las enzimas. (en fotocopias) Las vitaminas. (en fotocopias) 7.1. Vitaminas liposolubles. 7.2. Vitaminas hidrosolubles. 1. ENERGÍA DE ACTIVACIÓN En las células se producen constantemente numerosas reacciones químicas, unas encaminadas a sintetizas nuevas moléculas, y otras, a degradar las ya existentes. El conjunto de todas las reacciones bioquímicas se denomina metabolismo celular. Todas las reacciones metabólicas son catalizadas, es decir, necesitan la presencia de un enzima. Una reacción química implica la rotura de enlaces entre los átomo de los reactivos y la formación de nuevos enlaces que originan moléculas de los productos. Este proceso no se lleva a cabo directamente, sino a través de un estado intermedio, denominado estado de transición o complejo activado. Dicho estado es de vida muy corta, en el que los enlaces de los reactivos están debilitados, pero en el que aún no se han formado los nuevos. Para alcanzar este estado de transición hay que comunicar a los reactivos cierta cantidad de energía, llamada energía de activación (EA). En toda reacción se comprueba que si disminuye la energía de activación aumenta la velocidad de la reacción.
- 2. ¿Cómo podemos disminuir la energía de activación y así aumentar la velocidad de una reacción química? Podemos hacerlo de dos formas: - Aumentando la temperatura - Añadiendo un catalizador. En biología las enzimas son los catalizadores (biocatalizadores) de las reacciones biológicas. 2. ESTRUCTURA Y FUNCIÓN DE LAS ENZIMAS Las enzimas tienen las siguientes características: Disminuyen la energía de activación, acelerando así la velocidad de la reacción química. (la cual se mide por la cantidad de producto que se forma por unidad de tiempo). No modifican el estado de equilibrio de una reacción. Quedan libres al final de una reacción. NO se consumen a lo largo de la reacción. Basta una pequeña cantidad de la misma para aumentar la velocidad de la reacción. Presentan elevado peso molecular. Son proteínas globulares (solubles en agua). Actúan siempre a la temperatura del ser vivo. Existe una enzima diferente para cada reacción (son específicas). La especificidad es del tipo llave (sustrato) – cerradura (enzima). Sufren desnaturalización (como el resto de proteínas), debido a cambios de pH, temperatura y concentración. Estructura: Las enzimas son proteínas que actúan tanto a nivel intracelular (en el interior de la célula donde se han formado), como extracelular (fuera de la célula). Según su estructura podemos distinguir dos tipos de enzimas: 1. Enzimas estrictamente proteícos (formadas por una o más cadenas polipeptídicas). 2. Holoenzimas. Formadas por una fracción proteica (denominada apoenzima) y una fracción no proteíca (denominada cofactor). El cofactor puede ser: a) Inorgánico. Iones metálicos, como Mg2+, Zn2+, etc. Se unen a la apoenzima y regulan su activdad. b) Orgánicos. Si se unen débilmente a la fracción proteica se denominan coenzimas (por ejemplo ATP, NADPH+, NADP+, FAD, CoA, ciertas vitaminas…). Si se une fuertemente se denominan grupo prostético (por ejemplo el grupo hemo de la catalasa). Los coenzimas actúan como dadores o receptores de grupos químicos, es decir, son transportadores de grupos químicos. A diferencia de los enzimas, si se modifican durante la reacción. La unión apoenzima – coenzima es temporal. Los coenzimas no suelen ser específicos de un solo tipo de enzimas, sino que en algunos casos pueden unirse a
- 3. varios, cada uno con una función diferente. Muchos son vitaminas o presentan vitaminas en su composición. Podemos distinguir dos tipos de coenzimas: a) De oxido-reducción. Transportan protones (H+) y electrones (e-). Ejemplos: NAD+, NADP+; FAD. b) Coenzimas de transferencia. Transportan radicales moleculares. Ejemplo ATP (transporta grupos fosfato) y el acetil coenzima A. En las enzimas podemos distinguir el llamado centro activo o centro catalítico. Constituye una parte pequeña del enzima, formada por aminoácidos, que facilita el anclaje del enzima al sustrato (es decir, es la región en la que el enzima se une al sustrato). Los ribozimas son unos ARN capaces de catalizar a otros ARN, quitándoles o añadiéndoles nucleótidos, sin consumirse ellos mismos. Son la excepción a que todos los enzimas son proteínas. La sustancia sobre la que actúa un enzima se denomina sustrato. 3. LA ACTIVIDAD ENZIMÁTICA ¿Cómo actúa un enzima? La enzima (E) se fija al sustrato (S) en su superficie (adsorción) mediante enlaces débiles, formando el llamado complejo enzima sustrato (E-S). La unión E-S se realiza a través del centro activo del enzima. El centro activo se modifica para ajustarse mejor al sustrato (proceso conocido como acoplamiento mano-guante). La unión se realiza gracias a los radicales de algunos aminoácidos, que se establecen con el sustrato. Finalmente el complejo E-S se escinde, liberando el enzima intacto (se recupera así al final de la reacción) y el producto (P). 4. CINÉTICA DE UNA REACCIÓN ENZIMÁTICA Una reacción catalizada por un enzima se puede representar de la siguiente forma: E + S ES E + P Supongamos una reacción enzimática en la que se mantiene constante la concentración de enzima. Si se mantiene la concentración de la enzima constante y variamos la concentración de sustrato se obtiene una curva hiperbólica como la de la figura. Al principio un aumento de la concentración de sustrato produce un aumento rápido de la velocidad de reacción, pero si se sigue aumentando la concentración de sustrato, la velocidad de reacción comienza a disminuir; vemos que a muy altas concentraciones de sustrato se observa que no cambia la velocidad de reacción, se dice que los centros activos de la enzima se encuentran saturados(ello se debe a que todas las moléculas de enzima están saturadas por moléculas de sustrato, lo que se denomina saturación del enzima).
- 4. La velocidad de reacción que se obtiene a esa alta concentración de sustrato se define como la velocidad máxima (vmax) de la reacción enzimática bajo las condiciones especificadas. La concentración de substrato [S], a la semivelocidad máxima de reacción (½ v ) se puede determinar de la figura y representa la constante de Michaelis-Menten o km, la cual es una característica para cada enzima. La Km se pude definir como: la concentración de sustrato a la cual la velocidad de la reacción es la mitad de la velocidad máxima. Km depende de la afinidad que hay entre la enzima y sus sustrato. Un valor pequeño de Km indica una unión muy estrecha entre la enzima y el sustrato. Cuando menor sea el valor de Km mayor afinidad tendrá el enzima por el sustrato (es decir, antes se alcanza la velocidad semimáxima). 5. FACTORES QUE AFECTAN A LA ACTIVIDAD ENZIMÁTICA La velocidad de una reacción conseguida por un enzima además de depender de la concentración de substrato como hemos visto en el punto anterior, depende: Temperatura. Al aumentar la Temperatura en una reacción, las moléculas aumentan su movilidad y aumenta el número de choques, por lo que aumenta la velocidad con la que se forma el producto. Existe una temperatura óptima para la cual la actividad enzimática es máxima. Si la temperatura aumenta se dificulta la unión enzima-sustrato y a partir de cierta temperatura la enzima se desnaturaliza (pierde su estructura terciaria, cuaternaria (si la tiene), y, por tanto, pierde su función biológica. La mayoría de enzimas se inactivan a temperatura de 50-60 ºC, excepto las bacterias termófilas (resisten hasta temperatura de 100 ºC). Las enzimas de muchos mamíferos tienen una temperatura óptima de 370 C, por encima de esa temperatura comienzan a inactivarse y se destruyen pH. Los enzimas presentan 2 valores límite de pH entre los cuales son eficaces; traspasados estos valores, los enzimas se desnaturalizan y dejan de actuar. Entre los 2 límites existe un pH óptimo en el que la enzima presenta su máxima eficacia. Inhibidores Son sustancias que disminuyen la actividad de un enzima o bien impiden completamente la actuación de las mismas. Pueden ser perjudiciales o beneficiosos. Por ejemplo, la penicilina es un inhibidor de las enzimas que regulan la síntesis de la pared bacteriana, por lo que es útil contra la infección bacteriana. El AZT, es un inhibidor de la transcriptasa inversa, por lo que retrasa el desarrollo del SIDA. La inhibición puede ser de dos tipos: a) Irreversible “Venenos” E + I EI Suprimen completamente la actividad del enzima. El inhibidor se fija permanentemente al centro activo e inutiliza al enzima. Ej: Insecticidas
- 5. organofosforados, que inhiben a la enzima acetilcolinesterasa. Esto hace que no se destruya el neurotransmisor acetil-colina, provocando así una hiperactividad duradera que causa la muerte del insecto. Otro inhibidor es el ion cianuro ( potente veneno), que actúa sobre la citocromosidasa, que interviene en la respiración aerobia a) Reversible Las uniones I, E son mediante enlaces no convalentes ó fáciles de romper (iónicos o fuente hidrógeno). No se inutiliza el centro activo, sino que sólo se impide temporalmente su funcionamiento. Pueden ser : 1. Competitivas. Los inhibidores competitivos tienen una estructura espacial similar al sustrato, por lo que compite con éste en la fijación al centro activo de la enzima. E + I EI 2. No competitivas. La unión modifica la estructura del enzima al tiempo que dificulta al acoplamiento del sustrato. E + S + I ESI
- 6. 7.-LAS VITAMINAS Las vitaminas son glúcidos o lípidos sencillos que actúan como coenzimas y que en general los animales no pueden sintetizar o lo hacen en cantidad insuficiente, por lo que precisan ingeridas en la dieta. Su nombre provienen de que son imprescindibles para el mantenimiento de la vida, pese a que sólo se precisan en pequeñísimas cantidades, y a la que la primera vitamina que fue aislada poseía radicales amino. Son sustancias lábiles, que se alteran con facilidad con los cambios de temperatura, la luz, o los almacenamientos prolongados. Por ejemplo, la cocción de los alimentos reduce a la mitad la cantidad de vitaminas, de ahí la necesidad de ingerir alimentos frescos (frutas y ensaladas). Las vitaminas son sintetizadas por las plantas y por las bacterias. En ocasiones los animales no las encuentran del todo formadas en los alimentos, sino en forma de provitaminas, que precisan de posteriores transformaciones para dar lugar a las vitaminas. Por ejemplo, las vitaminas A y D. En otros casos la vitamina es aportada por la flora bacteriana, como sucede con la vitamina K. Se habla de avitaminosis si hay una carencia total de una determinada vitamina, hipovitaminosis si la carencia es parcial, e hipervitaminosis si existe un exceso de vitamina. Atendiendo a su solubilidad, las vitaminas se clasifican en: Vitaminas liposolubles. Son de naturaleza lipídica y por tanto solubles en disolventes orgánicos. Pertenecen a este grupo las vitaminas A, D, E y K. Vitaminas hidrosolubles. Son solubles en agua, y por tanto se difunden muy bien por la sangre. Su exceso no provoca trastornos, ya que son filtradas en el riñón, y eliminadas por la orina. Pertenecen a este grupo las vitaminas del completo B (vitaminas B1, B2, B3, B5, B6, B8, B9 y B12 ) y la vitamina C. (ver cuadro de vitaminas en hojas adjuntas fotocopiadas)