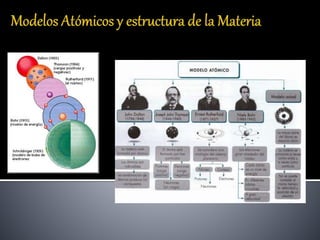
Modelos atómicos y estructura de la materia
- 2. Definimos átomo como la partícula más pequeña en que un elemento puede ser dividido sin perder sus propiedades químicas. La parte central del átomo, el núcleo atómico, tiene una carga positiva en la que se concentra casi toda su masa mientras que en la corteza, alrededor del núcleo atómico, hay un cierto número de electrones, que són unas partículas cargadas negativamente. El núcleo atómico está constituido por protones (con carga positiva) y neutrones (sin carga), denominados nucleones. La carga total del núcleo atómico (positiva) es igual a la carga negativa de los electrones, de modo que la carga eléctrica total del átomo sea neutra.
- 3. La ciudad griega de Alejandría en Egipto era un centro de saber alquímico que retuvo su preeminencia durante la mayor parte de las eras griega y romana. Los griegos se apropiaron de las creencias herméticas egipcias y las unieron con las filosofías pitagórica, jonista. La filosofía pitagórica es, esencialmente, la creencia en que los números gobiernan el universo, surgida de las observaciones del sonido, las estrellas y formas geométricas como los triángulos o cualquiera de la que pueda derivarse una razón. El pensamiento jonista se basaba en la creencia en que el universo podía ser explicado mediante la concentración en los fenómenos naturales; se cree que esta filosofía fue iniciada por Tales de Mileto y su pupilo Anaximandro y posteriormente desarrollada por Platón y Aristóteles, cuyas obras llegaron a ser una parte integral de la alquimia. Según esta creencia, el universo puede ser descrito por unas pocas leyes unificadas que pueden determinarse sólo mediante cuidadosas, minuciosas y arduas exploraciones filosóficas. Un concepto muy importante introducido en esta época, concebido por Empédocles y desarrollado por Aristóteles, fue que todas las cosas del universo estaban formadas por sólo cuatro elementos: tierra, aire, agua y fuego. Según Aristóteles, cada elemento tenía una esfera a la que pertenecía y a la que regresaría si se le dejaba intacto. Los cuatro elementos de los griegos eran aspectos mayoritariamente cualitativos de la materia y no cuantitativos como lo son nuestros elementos modernos. La auténtica alquimia nunca trató la tierra, el aire, el agua y el fuego como sustancias corpóreas o químicas en el sentido actual de la palabra. Los cuatro elementos era simplemente las cualidades primarias y más generales por medio de las cuales la sustancia amorfa y puramente cuantitativa de todos los cuerpos se presentaba primero en una forma diferenciada. Alquimistas posteriores desarrollaron extensivamente los aspectos místicos de este concepto.
- 4. Tales de Mileto: 625 A.C.-547 D.C. fue un filósofo y científico griego. Nació y murió en Mileto, polis griega de la costa Jonia (hoy en Turquía). Fue el iniciador de la escuela filosófica milesia a la que pertenecen también Anaximandro (su discípulo) y Anaxímenes (discípulo del anterior). En la antigüedad se le consideraba uno de los Siete Sabios de Grecia. Se le atribuyen desde el s. V a.C. importantes aportaciones en el terreno de la filosofía, las matemáticas, astronomía, física etc., así como un activo papel como legislador en su ciudad natal. Tales es a menudo considerado el iniciador de la especulación científica y filosófica griega y occidental, aunque su figura y aportaciones están rodeadas de grandes incertidumbres. Se suele aceptar que Tales comenzó a usar el pensamiento deductivo aplicado a la geometría, y se le atribuye la enunciación de dos teoremas geométricos que llevan su nombre. Expresó sus ideas en términos lógicos y no mitológicos. Se preguntó de que estaba hecho el mundo y se respondió a si mismo de agua.
- 5. Heráclito: Filósofo griego nacido en Éfeso, de origen aristocrático. Su padre fue el primer ciudadano o jefe político de Éfeso y Heráclito, que no pudo sucederle, cedió sus derechos a su hermano para poder dedicarse por completo a la filosofía. Escribió su obra en prosa jónica, en forma de aforismos, lo que le valió el epíteto de El Oscuro. Heráclito suele aparecer asociado por oposición a Parménides, oposición clásica que ya fue formulada por Platón y que parece haber trascendido la mera oposición terminológica para trasladarse a un esquema histórico. Como Tales de Mileto, Anaxímenes o Diógenes busca el principio general y fundamento del ser y de toda existencia. El principio de su filosofía es el logos, que identifica con el fuego, y afirma que la dialéctica es un camino hacia arriba y hacia abajo. El título de la obra de Heráclito se desconoce y Diógenes Laercio asegura que trataba de la naturaleza y estaba dividida en física, política y moral. El fuego heracliteano fue considerado el elemento calórico en el siglo XIX. Más tarde (con el cierre de la química y la física) se vio que el calórico como elemento, era inexistente. La fama de Heráclito se funda en Hegel y en la llamada escuela de hegelianos.
- 6. Empédocles de Agrigento: (495- 430 a. C.) fue un filósofo y político democrático griego. Cuando perdió las elecciones fue desterrado y se dedicó al saber. Postuló la teoría de las cuatro raíces, a las que Aristóteles más tarde llamó elementos, juntando el agua de Tales de Mileto, el fuego de Heráclito, el aire de Anaxímedes y la tierra de Jenófanes las cuales se mezclan en los distintos entes sobre la Tierra. Estas raíces están sometidas a dos fuerzas, que pretenden explicar el movimiento (generación y corrupción) en el mundo: el Amor, que las une, y el Odio, que las separa. Estamos, por tanto, en la actualidad, en un equilibrio. Esta teoría explica el cambio y a la vez la permanencia de los seres del mundo. El hombre es también un compuesto de los cuatro elementos. La salud consiste en cierto equilibrio entre ellos. El conocimiento es posible porque lo semejante conoce lo semejante: por el fuego que hay en nosotros conocemos el fuego exterior, y así los demás elementos. La sede del conocimiento sería la sangre, porque en ella se mezclan de modo adecuado los cuatro elementos de la naturaleza. Posteriormente Demócrito postularía que estos elementos están hechos de átomos. Sostiene una curiosa teoría sobre la evolución orgánica por su teoría de las raíces. Suponía que en un principio habría numerosas partes de hombres y animales distribuidas por azar: piernas, ojos, etc. Se formarían combinaciones aleatorias por atracción o Amor, dando lugar a criaturas aberrantes e inviables que no habrían sobrevivido: Muchas especies de criaturas vivas tienen que haber sido incapaces de propagar su linaje, ya que en cada una de las especies hoy día existentes o la industria o el valor o la velocidad ha protegido desde el principio su existencia, conservándola
- 7. Anaxímenes y Anaximandro: Anaximandro de Mileto: Sostenía que las sustancias estaban compuestas por combinaciones variables de partículas extremadamente pequeñas a las que llamaba “gérmenes o semillas” y en cualquier porción de materia hay algo de todo. fue un filósofo jonio considerado el primer científico, al usar la experimentación como método demostrativo. Nació hacia el año 610 a. C. en la ciudad jonia de Mileto (Asia Menor) y murió aproximadamente en el 546 a. C. Discípulo y continuador de Tales, compañero y maestro de Anaxímenes; se le atribuye sólo un libro, que es sobre la naturaleza, pero su palabra llega a la actualidad mediante comentarios doxográficos de otros autores. Se le atribuye también un mapa terrestre, la medición de los solsticios y equinoccios trabajos para determinar la distancia y tamaño de las estrellas y la afirmación de que la Tierra es cilíndrica y ocupa el centro del Universo. Anaxímedes de Mileto Nació el 585 a.C. en Mileto (Jonia), Asia Menor. Fue discípulo de Anaximandro. Se distinguió sobre todo como meteorólogo y astrónomo, además de filósofo. Se opuso a Anaximandro y a Tales de Mileto en la determinación del primer principio, que Anaxímenes considera ser el aire. Afirmaba que el aire es el elemento primario al que todas las demás cosas pueden ser reducidas. Explicó cómo los objetos sólidos se forman a partir del aire, para lo que introdujo las nociones de condensación y rarefacción. Creía que el aire se calienta y se vuelve fuego cuando se rarifica y que se enfría y se vuelve sólido al condensarse. La importancia de Anaxímenes no radica en su cosmología sino en su intento de descubrir la naturaleza última de la realidad. Escribió una obra en prosa que se ha titulado más tarde Peri Physeos (Sobre la Naturaleza), y que se ha perdido. Anaxímenes murió el 524 a.C.
- 8. Demócrito y Leucipo: Demócrito: 460 al 370 a. C., Sostenía que los cambios de la naturaleza pueden explicarse si se considera que la materia está compuesta por una única sustancia, repartida en partículas de distintas formas, no divisibles, eternas e inalterables, que llamó átomos. La apariencia de las cosas se debe a las diversas formas y maneras en que se agrupan. Dado que toda la materia esta formada por átomos y estos se mueven en el espacio, el espacio es vacío. Demócrito desarrolló la “teoría atómica del universo”, concebida por su mentor, el filósofo Leucipo. Esta teoría, al igual que todas las teorías filosóficas griegas, no apoya sus postulados mediante experimentos, sino que se explica mediante razonamientos lógicos. La teoría atomista de Demócrito y Leucipo se puede esquematizar así: Los átomos son eternos, indivisibles, homogéneos, incompresibles e invisibles. Los átomos se diferencian solo en forma y tamaño, pero no por cualidades internas. Las propiedades de la materia varían según el agrupamiento de los átomos. Leucipo: Puede que naciese en Abdera. Apenas se conoce algo de su vida y ninguno de sus escritos ha perdurado. Epicuro consideró la posibilidad de que Leucipo no hubiera existido. Es reconocido como creador de la teoría atómica de la materia, más adelante desarrollada por su principal discípulo, el filósofo griego Demócrito. Se dice que Demócrito inventó a Leucipo como su maestro para ganar prestigio y para que respaldasen su teoría, ya que se suponía que Leucipo era un gran físico. Según esta teoría, toda materia está formada por partículas idénticas e indivisibles llamadas átomos. Demócrito
- 9. Aristóteles: 384 a. C. – 322 a. C. fue un polímata: filósofo, lógico y científico de la Antigua Grecia cuyas ideas han ejercido una enorme influencia sobre la historia intelectual de Occidente por más de dos milenios Sostenía que el vacío no podía existir porque el espacio tiene que estar lleno con materia, a través de la cual se transmiten efectos físicos por medio del contacto directo. No aceptó que la materia estaba compuesta por átomos y vacío. Aristóteles escribió cerca de 200 tratados (de los cuales sólo nos han llegado 31) sobre una enorme variedad de temas, incluyendo lógica, metafísica, filosofía de la ciencia, ética, filosofía política, estética, retórica, física, astronomía y biología. Aristóteles transformó muchas, si no todas, las áreas del conocimiento que tocó. Es reconocido como el padre fundador de la lógica y de la biología, pues si bien existen reflexiones y escritos previos sobre ambas materias, es en el trabajo de Aristóteles donde se encuentran las primeras investigaciones sistemáticas al respecto. Entre muchas otras contribuciones, Aristóteles formuló la teoría de la generación espontánea, el principio de no contradicción, las nociones de categoría, sustancia, acto, potencia y primer motor inmóvil. Algunas de sus ideas, que fueron novedosas para la filosofía de su tiempo, hoy forman parte del sentido común de muchas personas. Aristóteles fue discípulo de Platón y de otros pensadores durante los veinte años que estuvo en la Academia de Atenas. Fue maestro de Alejandro Magno en el Reino de Macedonia. En la última etapa de su vida fundó el Liceo en Atenas, donde enseñó hasta un año antes de su muerte
- 10. Alquimia Definición: Técnica antigua practicada especialmente en la edad media, que se dedicaba principalmente a descubrir una sustancia que transmutaría los metales más comunes en oro y plata, y a encontrar medios de prolongar indefinidamente la vida humana. Aunque sus propósitos y procedimientos eran dudosos, y a menudo ilusorios, la alquimia fue en muchos sentidos la predecesora de la ciencia moderna, especialmente de la ciencia química. La alquimia nació en el antiguo Egipto, y empezó a florecer en Alejandría. Se considera que los escritos de algunos de los primeros filósofos griegos contienen las primeras teorías químicas; y la teoría expuesta en el siglo V a. C. por Empédocles influyó mucho en la alquimia. La alquimia, como sucedió con el resto de la ciencia árabe, se transmitió a Europa a través de España, gracias al extraordinario florecimiento que las ciencias y las artes experimentaron en Al-Andalus durante la edad media. El más famoso de todos los alquimistas fue el suizo Paracelso, que vivió en el siglo XVI. La aparición de la ciencia que llamamos "Química" requiere un proceso histórico más dilatado y lento que otras ramas de la ciencia moderna. Tanto en la antigüedad como en la Edad Media se contemplan esfuerzos por conocer y dominar de alguna forma los elementos materiales que constituyen el entorno físico que nos rodea. Averiguar cuáles sean los elementos originarios de los que están hechos todas las cosas así como establecer sus características, propiedades y formas de manipulación son las tareas primordiales que se encaminan al dominio efectivo de la naturaleza.
- 11. Periodos de la química Antigua: Edad de los metales: Se empiezan a utilizar los metales como el hierro, el cobre y el estaño Los Griegos: decían que todo estaba formado por 4 elementos: AGUA ( Tales de Mileto ), AIRE ( Anaxímenes ), FUEGO( Heráclito de Éfeso ) y TIERRA ( Empedocles ), y Aristóteles los unió todos. Alquimia Se le conoce la palabra: “chymia”: fundir un metal ( Árabe ) Se buscaban tres puntos esenciales: 1. La piedra filosofal 2. El elixir de la vida 3. Y la panacea universal (La cura de todas las enfermedades) Representante principal: Paracelso Iatroquimica: Aquí se dice que el cuerpo esta formado por 4 sustancias: Flema, Sangre, Bilis Negra y Amarilla, y que cuando uno de estas substancias faltaba, el cuerpo estaba enfermo. Empieza la edad de la medicina Representante era Roberto Boyle, “Padre de la química” ,inicio los estudios para Lavoisser y Dalton
- 12. Antoine Laurent de Lavoisier París, (26 de agosto de 1743-8 de mayo de 1794), químico, biólogo y economista francés, considerado el creador de la química moderna, junto a su esposa, la científica Marie-Anne , por sus estudios sobre la oxidación de los cuerpos, el fenómeno de la respiración animal, el análisis del aire, la ley de conservación de la masa o ley Lomonósov-Lavoisier, la teoría calórica y la combustión. Lavoisier realizó los primeros experimentos químicos realmente cuantitativos. Demostró que en una reacción, la cantidad de materia siempre es la misma al final y al comienzo de la reacción. Estos experimentos proporcionaron pruebas para la ley de conservación de la materia. Lavoisier también investigó la composición del agua y denominó a sus componentes oxígeno e hidrógeno. Entre los experimentos más importantes de Lavoisier fue examinar la naturaleza de la combustión, demostrando que es un proceso en el que se produce la combinación de una sustancia con oxígeno, refutando la teoría del flogisto. También reveló el papel del oxígeno en la respiración de los animales y las plantas. En el Tratado elemental de química, Lavoisier aclaró el concepto de elemento como una sustancia simple que no se puede dividir mediante ningún método de análisis químico conocido, y elaboró una teoría de la formación de compuestos a partir de los elementos. También escribió Memoria sobre la combustión (1777) y Consideraciones generales sobre la naturaleza de los ácidos
- 13. John Dalton (1766-1844).- Nació en Cumberland, Inglaterra. Las primeras investigaciones científicas de Dalton se desarrollaron en el campo de la meteorología Su primera obra fue Observaciones y ensayos meteorológicos (1793).Describió la ceguera hacia los colores en 1794, dicha enfermedad se conoce con el nombre de daltonismo por que el la padecía Su contribución más importante a la ciencia fue su teoría de “La materia está compuesta por átomos de diferentes masas que se combinan en proporciones sencillas para formar compuestos”. El modelo atómico de Dalton surgido en el contexto de la química, fue el primer modelo atómico con bases científicas, formulado en 1803 por John Dalton. El modelo permitió aclarar por primera vez por qué las sustancias químicas reaccionaban en proporciones estequiométricas fijas (Ley de las proporciones constantes) La corteza está formada por partículas muy pequeñas llamadas átomos, son indivisibles , no se pueden destruir. Los átomos de un mismo elemento son iguales entre sí, tienen la misma masa y propiedades. Los átomos de diferentes elementos tienen masas diferentes. Comparando las masas de los elementos con los del hidrógeno tomado como la unidad propuso el concepto de peso atómico relativo. Los átomos permanecen sin división, aun se combinen en las reacciones químicas. Los átomos, al combinarse para compuestos guardan relaciones simples. Los átomos de elementos diferentes pueden combinarse en proporciones distintas y formar más de un compuesto. Los compuestos químicos se forman al unirse átomos de dos o más elementos distintos. Las proporciones de estas relaciones son números enteros Fallas: La hipótesis de John Dalton, que afirmaba que los elementos en estado gaseoso eran monoatómicos y que los átomos de los elementos se combinaban en la menor proporción posible para formar átomos de los compuestos, lo que hoy llamamos moléculas, generó algunas dificultades. Por ejemplo, Dalton pensó que la fórmula del agua era HO. En consecuencia de esto se realizaron cálculos erróneos sobre la masa y peso de algunos compuestos básicos. En 1805, Gay-Lussac y von Humboldt mostraron que el agua estaba formada por dos hidrógenos y un oxígeno. En 1811, Amedeo Avogadro concretó la exacta composición del agua, basándose en lo que hoy se conoce como Ley de Avogadro y la evidencia de la existencia de moléculas diatómicas homonucleares. No obstante, estos resultados fueron ignorados en su mayor parte hasta 1860. Esto fue, en parte, por la creencia de que los átomos de un elemento no tenían ninguna afinidad química hacia átomos del mismo elemento. Además, algunos conceptos de la disociación de moléculas no estaban explicados en la Ley de Avogadro.
- 14. Joseph John Thomson (1856-1940).- nació el 18 de diciembre de 1856 en Manchester. 1906, obtuvo el Premio Nobel de Física por sus trabajos de la conducción de la electricidad a través de los gases. Se le considera el descubridor del electrón por sus experimentos con el flujo de partículas (electrones) que componen los rayos catódicos. Teórico y habilísimo experimentador, estudió a fondo dichos rayos catódicos. Después de haber demostrado claramente su naturaleza corpuscular, demostró asimismo, que tales partículas están cargadas negativamente; cuantificó directamente su energía y, en 1897, con un célebre experimento, determinó la relación entre su carga y su masa. En 1904 propuso un modelo atómico conocido como modelo del pudín de ciruelas, según el cual los electrones eran como 'ciruelas' negativas incrustadas en un 'pudín' de materia positiva. El nuevo modelo atómico usó la amplia evidencia obtenida gracias al estudio de los rayos catódicos a lo largo de la segunda mitad del siglo XIX. Si bien el modelo atómico de Dalton daba debida cuenta de la formación de los procesos químicos, postulando átomos indivisibles, la evidencia adicional suministrada por los rayos catódicos sugería que esos átomos contenían partículas eléctricas de carga negativa. El modelo de Dalton ignoraba la estructura interna, pero el modelo de Thomson aunaba las virtudes del modelo de Dalton y simultáneamente podía explicar los hechos de los rayos catódicos. Fallas Si bien el modelo de Thomson explicaba adecuadamente muchos de los hechos observados de la química y los rayos catódicos, hacía predicciones incorrectas sobre la distribución de la carga positiva en el interior de los átomos. Las predicciones del modelo de Thomson resultaban incompatibles con los resultados del experimento de Rutherford, que sugería que la carga positiva estaba concentrada en una pequeña región en el centro del átomo, que es lo que se conoció como núcleo atómico. El modelo siguiente fue el modelo atómico de Rutherford. Otro hecho que el modelo de Thomson había dejado por explicar era la regularidad de la tabla periódica de Mendeleiev. Los modelos de Bohr, Sommerfeld y Schrödinger finalmente explicarían las regularidades periódicas en las propiedades de los elementos químicos de la tabla, como resultado de una disposición más estructurada de los electrones en el átomo, que ni el modelo de Thomson ni el modelo de Rutherford habían considerado.
- 15. Ernest Rutherford (Zelanda, 1871-Londres, 1937) Físico y químico británico. Rutherford se trasladó a la Universidad de Cambridge (1895) para trabajar como ayudante de JJ. Thomson. Por sus trabajos en el campo de la física atómica, Ernest Rutherford está considerado como uno de los padres de esta disciplina. Investigó también sobre la detección de las radiaciones electromagnéticas y sobre la ionización del aire producida por los rayos X. Estudió las emisiones radioactivas descubiertas por H. Becquerel, y logró clasificarlas en rayos alfa, beta y gamma. El modelo de Rutherford fue el primer modelo atómico que consideró al átomo formado por dos partes: la "corteza", constituida por todos sus electrones, girando a gran velocidad alrededor de un "núcleo" muy pequeño; que concentra toda la carga eléctrica positiva y casi toda la masa del átomo. La importancia del modelo de Rutherford residió en proponer por primera vez la existencia de un núcleo en el átomo. Lo que Rutherford consideró esencial, para explicar los resultados experimentales, fue "una concentración de carga" en el centro del átomo, ya que sin ella, no podía explicarse que algunas partículas fueran rebotadas en dirección casi opuesta a la incidente. Este fue un paso crucial en la comprensión de la materia, ya que implicaba la existencia de un núcleo atómico donde se concentraba toda la carga positiva y más del 99,9% de la masa. Las estimaciones del núcleo revelaban que el átomo en su mayor parte estaba vacío. Rutherford propuso que los electrones orbitarían en ese espacio vacío alrededor de un minúsculo núcleo atómico, situado en el centro del átomo. Fallas: Por un lado se planteó el problema de cómo un conjunto de cargas positivas podían mantenerse unidas en un volumen tan pequeño, hecho que llevó posteriormente a la postulación y descubrimiento de la fuerza nuclear fuerte, que es una de las cuatro interacciones fundamentales. Por otro lado existía otra dificultad proveniente de la electrodinámica clásica que predice que una partícula cargada y acelerada, como sería el caso de los electrones orbitando alrededor del núcleo, produciría radiación electromagnética, perdiendo energía y finalmente cayendo sobre el núcleo. Las leyes de Newton, junto con las ecuaciones de Maxwell del electromagnetismo aplicadas al átomo de Rutherford llevan a que en un tiempo del orden de s, toda la energía del átomo se habría radiado, con la consiguiente caída de los electrones sobre el núcleo. Se trata, por tanto de un modelo físicamente inestable, desde el punto de vista de la física clásica. Según Rutherford, las órbitas de los electrones no están muy bien definidas y forman una estructura compleja alrededor del núcleo, dándole un tamaño y forma algo indefinidas. Los resultados de su experimento le permitieron calcular que el radio atómico era diez mil veces mayor que el núcleo mismo, y en consecuencia, que el interior de un átomo está prácticamente vacío.
- 16. Niels Bohr (Copenhague, 1885 - 1962) Físico danés. Considerado como una de las figuras más deslumbrantes de la Física contemporánea por sus aportaciones teóricas y sus trabajos prácticos, como uno de los padres de la bomba atómica, 1922 ganó el Premio Nobel de Física, "por su investigación acerca de la estructura de los átomos y la radiación que emana de ellos". Viajó a Inglaterra para ampliar sus conocimientos en el prestigioso Cavendish Laboratory de la Universidad de Cambridge, bajo la tutela de sir Joseph John Thomson (1856-1940) Los electrones describen órbitas circulares en torno al núcleo del átomo sin radiar energía. La causa de que el electrón no radie energía en su órbita es, de momento, un postulado, ya que según la electrodinámica clásica una carga con un movimiento acelerado debe emitir energía en forma de radiación. Para conseguir el equilibrio en la órbita circular, las dos fuerzas que siente el electrón: la fuerza coulombiana, atractiva, por la presencia del núcleo y la fuerza centrífuga, repulsiva por tratarse de un sistema no inercial, deben ser iguales en magnitud en toda la órbita Fallas El modelo falla para proporcionar una explicación de porque ciertas lineas espectrales en el espectro del hidrógeno son más brillantes que otras, esto es no proporcionaba una manera satisfactoria para poder calcular la probabilidad de transición de un estado cuántico a otro. Es decir, el modelo no tiene ningún mecanismo para calcular las probabilidades de transición entre estados estacionarios. El modelo de Bohr trata al electrón como si fuera un planeta en miniatura, con un radio definido de órbita y de momento. Este supuesto es una directa violación del principio de incertidumbre, un principio clave la la Mecánica Cuántica el cual dicta que el mundo cuántico la posición y el momento no pueden ser simultáneamente determinado. El modelo de Bohr proporciona un modelo conceptual básico de órbitas de electrones y energías. Los detalles del espectro y la distribución de carga requiere de los cálculos de la mecánica cuántica que utilizan la ecuación de Schrödinger.
- 17. Amedeo Avogadro (Turín, 9 de agosto de 1776 - Turín, 9 de julio de 1856) fue un físico y químico italiano, profesor de física de la Universidad de Turín desde 1820 hasta su muerte. Formuló la llamada Ley de Avogadro, que dice que volúmenes iguales de gases distintos bajo las mismas condiciones de presión y temperatura, contienen el mismo número de partículas. Avanzó en el estudio y desarrollo de la teoría atómica, y en su honor se le dio el nombre al Número de Avogadro. Ley de Avogadro: Una de las leyes de los gases ideales. Toma el nombre de Amedeo Avogadro, quien en 1811 afirmó que: "En iguales condiciones de presión y temperatura las densidades relativas de los cuerpos gaseosos son proporcionales a sus pesos atómicos. "Y sugirió la hipótesis: "Volúmenes iguales de distintas sustancias gaseosas, medidos en las mismas condiciones de presión y temperatura, contienen el mismo número de partículas."Por partículas debemos entender aquí moléculas, ya sean éstas poliatómicas (formadas por varios átomos, como O2, CO2 o NH3) o monoatómicas (formadas por un solo átomo, como He, Ne o Ar). Numero de Avogadro: Como mol se denomina a la unidad contemplada por el Sistema Internacional de Unidades que permite medir y expresar a una determinada cantidad de sustancia. Se trata de la unidad que emplean los químicos para dar a conocer el peso de cada átomo, una cifra que equivale a un número muy grande de partículas. Un mol, de acuerdo a los expertos, equivale al número de átomos que hay en doce gramos de carbono-12 puro. La ecuación sería la siguiente: 1 mol = 6,022045 x 10 elevado a 23 partículas. Dicha cantidad suele redondearse como 6,022 x 10 elevado a 23 y recibe el nombre de número de Avogadro (en ocasiones presentado como constante de Avogadro) en honor al científico de nacionalidad italiana Amedeo Avogadro (1776-1856), quien también formuló la ley que afirma que, en condiciones iguales de temperatura y presión, volúmenes idénticos de gases diferentes poseen igual cantidad de partículas. La utilidad de la constante de Avogadro radica en la necesidad de contar partículas o entidades microscópicas a partir de medidas macroscópicas (como la masa).
- 18. Wilhelm Conrad Röntgen (Lennep 27 de marzo de 1845 - 10 de febrero de 1923) fue un físico alemán, de la Universidad de Würzburg, que el 8 de noviembre de 1895 produjo radiación electromagnética en las longitudes de onda correspondiente a los actualmente llamados rayos X. En los años siguientes, Röntgen publicó unos estudios sobre un nuevo tipo de rayos, que fueron traducidos al inglés, francés, italiano y ruso. Por su descubrimiento fue galardonado en 1901 con el primer premio Nobel de Física. El premio se concedió oficialmente en reconocimiento de los extraordinarios servicios que ha brindado para el descubrimiento de los notables rayos que llevan su nombre. Röntgen donó la recompensa monetaria a su universidad. De la misma forma que Pierre Curie haría varios años más tarde, rechazó registrar cualquier patente relacionada a su descubrimiento por razones éticas. Tampoco quiso que los rayos llevaran su nombre, sin embargo en alemán los rayos X se siguen conociendo como Röntgenstrahlen (rayos Röntgen). La Universidad de Wurzburgo le otorgó el grado honorario de Doctor en Medicina. También en su honor recibe tal nombre la unidad de medida de la exposición a la radiación, establecida en 1928: véase Roentgen (unidad).
- 19. Antoine Henri Becquerel (París, 15 de diciembre de 1852 - Le Croisic, 25 de agosto de 1908, con 55 años.) Fue un físico francés descubridor de la radiactividad y galardonado con el Premio Nobel de Física del año 1903. En el año 1896 descubrió una nueva propiedad de la materia que posteriormente se denominó radiactividad. Este fenómeno se produjo durante su investigación sobre la fosforescencia. Al colocar sales de uranio sobre una placa fotográfica en una zona oscura, comprobó que dicha placa se ennegrecía. Las sales de uranio emitían una radiación capaz de atravesar papeles negros y otras sustancias opacas a la luz ordinaria. Estos rayos se denominaron en un principio rayos Becquerelen honor a su descubridor. También este personaje gracias a sus valiosas investigaciones y descubrimientos hizo aportes al modelo atómico. Tras el descubrimiento, a finales de 1895, de los Rayos X por Wilhelm Röntgen, Becquerel observó que éstos, al impactar con un haz de rayos catódicos en un tubo de vidrio en el que se ha hecho el vacío, se tornaban fluorescentes. A raíz de esta observación, se propuso averiguar si existía una relación fundamental entre los rayos X y la radiación visible, de tal modo que todos los materiales susceptibles de emitir luz, estimulados por cualquier medio, emitan, así mismo, rayos X. Para comprobar esta hipótesis, colocó cristales sobre una placa fotográfica envuelta en papel opaco, de tal forma que sólo la radiación invisible, correspondiente a los rayos X, pudiera revelar la emulsión contenida en la placa; previamente excitó los cristales mediante exposición a la luz solar. Al cabo de unas horas comprobó que la placa revelaba la silueta perfilada por los cristales.
- 20. Ernest Rutherford: Investigo la radiación del uranio el Radio, y otros elementos Radioactivos, cuando hizo pasar esta radiación por el campo magnético intenso, observo que los rayos se separaban, se desviaban en direcciones distintas. Las partículas que constituyen los rayos alfa que Ernest descubrió tienen carga doblemente positiva, por lo tanto se desvían hacia el lado negativo. Con los rayos Beta, se desvían hacia el lado positivo, es como la inversa a los rayos alfa. Los rayos Gamma resultaron ser parecidos a los rayos X pero mas penetrantes aunque no tienen masa ni carga. Marie Curie y Pierre Curie: Nacio en Polonia 1867, esposa de Pierre Curie, aislo muestras de 2 elementos nuevos ademas del Uranio que fueron: el Radio (Ra) y el Polonio (Po) utilizo el nombre de Polonio, por que era su pais natal y utilizo Radio por sus altos niveles de radioactividad el Radio se utilizo para tratamientos de cancer. Fue la primera en ganar 2 premios Nobel de la Ciencia. Pierre murio en un accidente de transito y Marie de Anemia perniciosa, probablemente causada por la exposición a los materiales radioactivos.
- 21. En física, el protón es una partícula subatómica con una carga eléctrica elemental positiva 1 (1,6 × 10-19 C). Igual en valor absoluto y de signo contrario a la del electrón, y una masa 1.836 veces superior a la de un electrón. Experimentalmente, se observa el protón como estable, con un límite inferior en su vida media de unos 1035 años, aunque algunas teorías predicen que el protón puede desintegrarse en otras partículas. El protón y el neutrón, en conjunto, se conocen como nucleones, ya que conforman el núcleo de los átomos. En un átomo, el número de protones en el núcleo determina las propiedades químicas del átomo y qué elemento químico es. El núcleo del isótopo más común del átomo de hidrógeno (también el átomo estable más simple posible) está formado por un único protón. Al tener igual carga, los protones se repelen entre sí. Sin embargo, pueden estar agrupados por la acción de la fuerza nuclear fuerte, que a ciertas distancias es superior a la repulsión de la fuerza electromagnética. No obstante, cuando el átomo es grande (como los átomos de Uranio), la repulsión electromagnética puede desintegrarlo progresivamente. Generalmente se le acredita a Ernest Rutherford el descubrimiento del protón. En el año 1918 Rutherford descubrió que cuando se disparan partículas alfa contra un gas de nitrógeno, sus detectores de centello muestran los signos de núcleos de hidrógeno. Rutherford determinó que el único sitio del cual podían provenir estos núcleos era del nitrógeno y que por tanto el nitrógeno debía contener núcleos de hidrógeno. Por estas razones Rutherford sugirió que el núcleo de hidrógeno, que en la época se sabía que su número atómico era 1, debía ser una partícula fundamental. Características: 1) Se encuentran en el núcleo de elemento (átomo) 2) Son de carga (+) Positivos 3) número atómico = numero de protones 4) número másico = No. de protones + no de neutrones Estructura de Quarks de un protón 2 quark arriba 1 abajo
- 22. El neutrón es una partícula subatómica, un nucleón, sin carga , presente en el núcleo atómico de prácticamente todos los átomos, excepto el protio. Aunque se dice que el neutrón no tiene carga, en realidad está compuesto por tres partículas fundamentales cargadas llamadas quarks, cuyas cargas sumadas son cero. Por tanto, el neutrón es un barión neutro compuesto por dos quarks de tipo abajo, y un quark de tipo arriba. Fuera del núcleo atómico, los neutrones son inestables, teniendo una vida media de 15 minutos (885,7 ± 0,8 s);cada neutrón libre se descompone en un electrón, un antineutrino y un protón. Su masa es muy similar a la del protón, aunque ligeramente mayor. El neutrón es necesario para la estabilidad de casi todos los núcleos atómicos, a excepción del isótopo hidrógeno-1. La interacción nuclear fuerte es responsable de mantenerlos estables en los núcleos atómicos. Fue descubierto por James Chadwick en el año de 1932. Se localiza en el núcleo del átomo. Antes de ser descubierto el neutrón, se creía que un núcleo de número de masa A (es decir, de masa casi A veces la del protón) y carga Z veces la del protón, estaba formada por A protones y A-Z electrones. Pero existen varias razones por las que un núcleo no puede contener electrones. Un electrón solamente podría encerrarse en un espacio de las dimensiones de un núcleo atómico (10-12 cm) si fuese atraído por el núcleo mediante una fuerza electromagnética muy fuerte e intensa; sin embargo, un campo electromagnético tan potente no puede existir en el núcleo porque llevaría a la producción espontánea de pares de electrones negativos y positivos (positrones) Características: 1)Se encuentran junto con los protones en el núcleo. 2) Son de carga neutra. 3) Son los constitutivos fundamentales del núcleo atómico 4) se les considera como dos formas de una misma partícula: el núcleo Estructura de Quarks de un Neutrón 2 Quarks abajo 1 arriba
- 23. http://energia-nuclear.net/definiciones/atomo.html http://web.educastur.princast.es/proyectos/formadultos/unidades/materiayenergia/udos_capcinco_pauno.htm https://www.google.com.mx/search?q=electron+proton+y+neutron&espv=210&es_sm=122&tbm=isch&tbo=u&sou rce=univ&sa=X&ei=dcdleria%252F%3B421%3B212 http://es.wikipedia.org/wiki/Anaximandro http://html.rincondelvago.com/la-alquimia.html http://www.scribd.com/doc/67619311/Periodos-de-la-quimica http://www.preceden.com/timelines/15589-historia-de-la-quimica http://es.wikipedia.org/wiki/Tales_de_Mileto http://symploke.trujaman.org/index.php?title=Her%E1clito http://www.scribd.com/doc/67619311/Periodos-de-la-quimica http://www.buenastareas.com/ensayos/Aportaciones-De-La-Quimica/2703292.html http://es.wikipedia.org/wiki/Anax%C3%ADmenes http://www.buscabiografias.com/bios/biografia/verDetalle/484/Anaximandro http://es.wikipedia.org/wiki/Modelo_at%C3%B3mico_de_Bohr http://es.wikipedia.org/wiki/Niels_Bohr http://www.biografiasyvidas.com/biografia/b/bohr.htm http://es.wikipedia.org/wiki/Neutr%C3%B3n http://definicion.de/numero-de-avogadro/ https://www.google.com.mx/webhp?hl=es&tab=Tw#hl=es&q=caracteristicas%20de%20los%20protones http://answers.yahoo.com/question/index?qid=20080325103549AAWwgk3
- 24. 1. Ralph A Burns “Fundamento de la Química” Quinta edición México Bachilleres Ciencias 2011 Pág.. 776 2. María Guadalupe Osuna Coronado “Química General” Primera Edición Tres Guerras 27 06040 Mex. D.F. 2002 Pág. 209 3. Raymond Chang “Química “ Álvaro Obregón Santa Fe Mex. D.F. Décima Edición 2010 Pág. 1093 4. Raymond Chang Química General para Bachilleres Cuarta Edición Álvaro Obregón Santa Fe Mex. D.F. 2006 Pág. 748
- 25. Equipo 1 Frida Zamora Argeo Lupercio Neftali Escamilla Paula Cordova Cesar Prado