Propriedades químicas dos aminoácidos
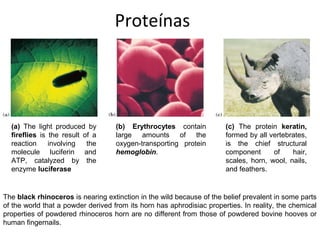
- 1. Proteínas (a) The light produced by (b) Erythrocytes contain (c) The protein keratin, fireflies is the result of a large amounts of the formed by all vertebrates, reaction involving the oxygen-transporting protein is the chief structural molecule luciferin and hemoglobin. component of hair, ATP, catalyzed by the scales, horn, wool, nails, enzyme luciferase and feathers. The black rhinoceros is nearing extinction in the wild because of the belief prevalent in some parts of the world that a powder derived from its horn has aphrodisiac properties. In reality, the chemical properties of powdered rhinoceros horn are no different from those of powdered bovine hooves or human fingernails.
- 2. Composição molecular de uma célula de E. coli
- 3. Estrutura geral dos amionoácidos de ocorrência biológica Grupamento carboxilato (ácido carboxílico) Grupamento amino Hidrogênio Exceção: Grupamento “R”, ou cadeia lateral Essa parte é que define as propriedades cada aminoácido de acordo com suas características de estrutura, tamanho, caga elétrica , solubilidade prolina
- 4. Os aminoácidos possuem (pelo menos) um carbono quiral B A B C D A C D Centro quiral Exceção: Estéreo isômeros (enantiomeros) Ópticamente ativos, isto é mudam o plano de polarização da luz polarizada Os aminoácidos utilizados nas proteínas são L-estereoisômeros glicina
- 6. Uma classificação dos aminoácidos
- 8. Apolares alifáticos Prolina: tem uma cadeia alifática Alanina , valina, leucina e isoleucina ciclica na sua cadeia lateral. Sua tendem a se agrupar no interior das amina secundária (imino) confere proteínas, estabilizando sua esrutura por rigidez à região do polipeptídeo onde meio de interações hidrofóbicas. está presente. Glicina: É o que tem a estrutura mais simples. Embora esteja classificada como apolar, sua cadeia lateral é muito pequena para contribuir com as interações hidrofóbicas Metionina possui um grupamento tioéter apolar (contendo enxofre) na sua cadeia lateral.
- 9. Polares não carregados São mais hidrofílicos que os aminoácidos apolares porque contém grupamentos funcionais capazes de fazer pontes de hidrogênio com a água. A polaridade as serina e da treonina é devida ao seus grupamentos hidroxila (–OH). A polaridade da cisteína é devida ao seu grupamentoa sulfidrila (-SH). Os grupamentos amida conferem polaridade às cadeias laterais da asparagina e da glutamina Asparagina e glutamina são amidas de outros dois aminoácidos também Aspartato Glutamato encontrados em proteínas: aspartato e glutamato
- 10. Cisteína e Cistina A cisteína é facilmente oxidada para formar um dímero através de uma ligação covalente do tipo dissulfeto . Esse dímero, que se chama cistína, é extremamente apolar . As ligações dissulfeto tem um papel muito importante na estrutura de muitas proteínas formando ligações covalentes entre diferentes partes de uma molécula de proteína
- 11. Aminoácidos aromáticos São relativamente apolares (hidrofóbicos). Os três podem participar de interações hidrofóbicas O grupamento hidroxila da tirosina pode formar pontes de hidrogênio, é um importante grupamento funcional no sítio catalítico de fenol algumas enzimas. indol Tirosina e triptofano são significativamente mais polares do que fenilalanina, devido a hidroxila fenólica da tirosina e ao nitrogênio indólico do triptofano
- 12. Grupamentos R com carga positiva (básicos) Muito hidrofílicos Apresentam carga elétrica positiva em pH fisiológico Lisina contem uma amina primária imidazol Arginina contém um grupamento guanidino amina guanidino Histidina contém um grupamento imidazol
- 13. Grupamentos R com carga negativa (ácidos) Possuem carga negativa em pH fisiológico.
- 14. Os aminoácidos podem se comportar como ácidos e como bases Doador de H+ Aceptor de H+ Substância anfotérica,ou anfólito, ou anfiprótico
- 15. Curva de titulação da glicina 1+ 0 1- Dois patamares de tamponamento, um para cada grupamento ativo do ponto de vista ácido-base: uma amina e uma carboxila. Em pH extremamente baixo temos a predominância da forma totalmente protonada Em pH 2.34 ( pH =pKa temos a carboxila semititulada e quantidades equimolares das espécies negativa e neutra. Em pH 5,97 a carboxila está totalmente titulada, a espécie zwiteriônica é a predominante Informações obtidas com a curva de titulação: Dois patamares de tamponamento Valores de pK1 e pK2 Espécies envolvidas e suas cargas elétricas
- 16. Curva de titulação do glutamato 1+ 0 1- 2- Quantos patamares? R: três Quais os valores de pKs? Quais as espécies (os estados de protonação do glutamato) envolvidas? Quais as cargas líquidas de cada espécie?
- 17. Propriedades químicas e convenções relacionadas aos pK da Código de Código de Peso pK do Peso pK do carboxilato carboxilato aminoácidos pK da cadeia cadeia Códigomolecular uma Códigomolecular uma pK da pK da lateral três letras letra três letras letra lateral amina amina !!!?? !!!??
- 18. Propriedades químicas e convenções relacionadas aos aminoácidos (cont.) pI – PontoÍndice de pI – Ponto isoelétrico Índice de hidrofobicid isoelétrico hidrofobicid O que é Ponto isoelétrico? O que é Ponto isoelétrico? ade Frequencia (%) ade Frequencia (%) Ponto isoelétrico é o valor Ponto isoelétrico é o valor de pH no qual a soma total de pH no qual a soma total das cargas de uma das cargas de uma molécula (carga líquida) é molécula (carga líquida) é igual a zero igual a zero pI > 7 pI > 7 básicos básicos O que é Índice de O que é Índice de pI < 7 pI < 7 hidrofobicidade?simplesmente uma É hidrofobicidade?simplesmente uma É ácidos ácidos estatística que mostra o estatística que mostra o É uma escala teórica que procura estimar se das cadeias laterais dos É uma escala teórica que procura estimar se das cadeias laterais dos percentual com que cada percentual com que cada aminoácios vão procurar ambientes aquosos (como o citoplasma) ou aminoácios vão procurar ambientes aquosos (como o citoplasma) ou aminoácido aparece num aminoácido aparece num lipídicos (como as membranas celulares). Valores negativos lipídicos (como as membranas celulares). Valores negativos universo de 1500 proteínas universo de 1500 proteínas indicam hidrofilicidade, enquanto valores positivos indicam indicam hidrofilicidade, enquanto valores positivos indicam seqüenciadas seqüenciadas hidrofobiciadade. hidrofobiciadade. Pode ser usado para estimar como uma proteína de membrana se Pode ser usado para estimar como uma proteína de membrana se insere na bicamada lipídica insere na bicamada lipídica
- 19. Peptídeos são cadeias de aminoácidos Dois aminoácidos podem se ligar covalentemente através de uma ligação peptídica (amarelo) pra formar um dipeptídeo Essa ligação ocorre com a liberação de uma molécula de água. Trata-se de uma reação de condensação Em condições bioquímicas padrão o equilíbrio está favorece a formação de aminoácidos em fez de dipeptídeos. Para deslocar a reação no sentido de polimerização é nescessário ativar o ácido carboxílico. Mais aminoácidos podem ser adicionados de forma parecida formando tri-, tetra-, pentapeptídeos e assim por diante... As proteínas são polímeros lineares de centenas a milhares de aminoácidos
- 20. Peptídeos e Proteínas Cadeias laterais Seril-glicil-tyrosil-alanil-leucina Ser–Gly–Tyr–Ala–Leu Amino Carboxi terminal Ligações peptídicas terminal A nomenclatura começa pela ponta amino-terminal, que é escrita à esquerda Embora a hidrólise das ligações peptídicas seja uma reação exergônica (favorável termodinamicamente) ela ocorre lentamente devido à sua alta energia de ativação. Isso quer dizer que as ligações peptídicas são bem estáveis, apresentam uma meia- vida de sete anos na maioria das condições fisiológicas.
- 21. Dados moleculares sobre algumas proteínas
- 22. Composição de aminoácidos de duas proteínas
- 23. Algumas proteínas apresentam outros grupamentos químicos além de aminácidos
- 24. Lipoproteina (ex.) Lipoproteína de baixa densidade LDL Função: transporte de lipídeos Composição: Apoprotéinas Ester de colesterol Colesterol Fosfolipídios Triacilgliceróis
- 25. Glicoproteína (ex.) Glicoproteínas de superfície celular Função: Reconhecimento celular Proteção Hidratação
- 26. Heme proteína (ex. 1) Hemoglobina Funções: Transporte de O2 Transporte de CO2
- 27. Heme proteína (ex. 2) Citocromos: Função: Cadeia de transporte de elétrons (respiração celular)
- 28. Heme proteína (ex. 3) Citocromos P450 Funções Detoxificação Síntese de hormônios esteróides OBS: Freqüentemente tem atividade de hidroxilação
- 29. Níveis na estrutura de proteínas A estrutura primária seqüência de aminoácidos unidos por ligações peptídicas e inclui todas as pontes dissulfeto. Estrutura secndária padroês em hélice, folhas, e alças frequentemente assumidos Estrutura terciária como os blocos (domínios) de estrutura secundária se agrupam para formar monomêros Estrutura quaternária como os monomêros se agrupam para formar oligomêros
- 30. Fatores que participam no enovelamento de uma proteína Interações hidrofóbicas Pontes dissufeto Pontes de hidrogênio As cadeias laterais dos aminoácidos determinam o enovelamento das proteínas Interações eltroestáticas
Notas del editor
- Polar, Uncharged R Groups The R groups of these amino acids are more soluble in water, or more hydrophilic, than those of the nonpolar amino acids, because they contain functional groups that form hydrogen bonds with water. This class of amino acids includes serine, threonine, cysteine, asparagine, and glutamine. The polarity of serine and threonine is contributed by their hydroxyl groups; that of cysteine by its sulfhydryl group; and that of asparagine and glutamine by their amide groups. Asparagine and glutamine are the amides of two other amino acids also found in proteins, aspartate and glutamate, respectively, to which asparagine and glutamine are easily hydrolyzed by acid or base. Cysteine is readily oxidized to form a covalently linked dimeric amino acid called cystine, in which two cysteine molecules or residues are joined by a disulfide bond (Fig. 3–7). The disulfide-linked residues are strongly hydrophobic (nonpolar). Disulfide bonds play a special role in the structures of many proteins by forming covalent links between parts of a protein molecule or between two different polypeptide chains.
- Nonpolar, Aliphatic R Groups The R groups in this class of amino acids are nonpolar and hydrophobic. The side chains of alanine, valine, leucine, and isoleucine tend to cluster together within proteins, stabilizing protein structure by means of hydrophobic interactions. Glycine has the simplest structure. Although it is formally nonpolar, its very small side chain makes no real contribution to hydrophobic interactions. Methionine, one of the two sulfur-containing amino acids, has a nonpolar thioether group in its side chain. Proline has an
- Polar, Uncharged R Groups The R groups of these amino acids are more soluble in water, or more hydrophilic, than those of the nonpolar amino acids, because they contain functional groups that form hydrogen bonds with water. This class of amino acids includes serine, threonine, cysteine, asparagine, and glutamine. The polarity of serine and threonine is contributed by their hydroxyl groups; that of cysteine by its sulfhydryl group; and that of asparagine and glutamine by their amide groups. Asparagine and glutamine are the amides of two other amino acids also found in proteins, aspartate and glutamate, respectively, to which asparagine and glutamine are easily hydrolyzed by acid or base. Cysteine is readily oxidized to form a covalently linked dimeric amino acid called cystine, in which two cysteine molecules or residues are joined by a disulfide bond (Fig. 3–7). The disulfide-linked residues are strongly hydrophobic (nonpolar). Disulfide bonds play a special role in the structures of many proteins by forming covalent links between parts of a protein molecule or between two different polypeptide chains.
- Cysteine is readily oxidized to form a covalently linked dimeric amino acid called cystine, in which two cysteine molecules or residues are joined by a disulfide bond (Fig. 3–7). The disulfide-linked residues are strongly hydrophobic (nonpolar). Disulfide bonds play a special role in the structures of many proteins by forming covalent links between parts of a protein molecule or between two different polypeptide chains.
- Aromatic R Groups Phenylalanine, tyrosine, and tryptophan, with their aromatic side chains, are relatively nonpolar (hydrophobic). All can participate in hydrophobic interactions. The hydroxyl group of tyrosine can form hydrogen bonds, and it is an important functional group in some enzymes. Tyrosine and tryptophan are significantly more polar than phenylalanine, because of the tyrosine hydroxyl group and the nitrogen of the tryptophan indole ring.
- Positively Charged (Basic) R Groups The most hydrophilic R groups are those that are either positively or negatively charged. The amino acids in which the R groups have significant positive charge at pH 7.0 are lysine, which has a second primary amino group at the position on its aliphatic chain; arginine, which has a positively charged guanidino group; and histidine, which has an imidazole group. Histidine is the only common amino acid having an ionizable side chain with a p Ka near neutrality. In many enzyme-catalyzed reactions, a His residue facilitates the reaction by serving as a proton donor/acceptor.
- Negatively Charged (Acidic) R Groups The two amino acids having R groups with a net negative charge at pH 7.0 are aspartate and glutamate, each of which has a second carboxyl group.
- The plot has two distinct stages, corresponding to deprotonation of two different groups on glycine At very low pH, the predominant ionic species of glycine is the fully protonated form, H3NOCH2 OCOOH.
