Modelo atomico de thomson
- 1. Modelo Atomico De Thomson
- 2. Joseph John Thomson • Thomson nació en 1856 en Cheetham Hill, un distrito de Mánchester en Inglaterra, y tenía ascendencia escocesa. • Físico británico. Hijo de un librero, Joseph John Thomson estudió en el Owens College y más tarde en la Universidad de Manchester y en el Trinity College de Cambridge. Se graduó en matemáticas en 1880, ocupó la cátedra Cavendish y, posteriormente, fue nombrado director del Laboratorio Cavendish de la Universidad de Cambridge. • Thomson investigó la naturaleza de los rayos catódicos y demostró que los campos eléctricos podían provocar la desviación de éstos. Llevó a cabo numerosos experimentos sobre su desviación, bajo el efecto combinado de campos eléctricos y magnéticos, buscando la relación existente entre la carga y la masa de la partículas, proporcionalidad que se mantenía constante aun cuando se alterase el material del cátodo. • En 1897 descubrió una nueva partícula y demostró que era aproximadamente mil veces más ligera que el hidrógeno. Esta partícula sería bautizada con el nombre de electrón, designación propuesta años antes por el irlandés George Johnstone Stoney, que había teorizado sobre su existencia. • Joseph John Thomson fue el primero que identificó partículas subatómicas, y llegó a importantes conclusiones sobre estas partículas cargadas negativamente: con el aparato que construyó obtuvo la relación entre la carga eléctrica y la masa del electrón. • El premio novel de física lo obtiene en 1906, gracias al trabajo que realizo sobre la conducción de la electricidad a través de los gases. • Thomson murió el 30 de agosto de 1940, Cambridge, Reino Unido
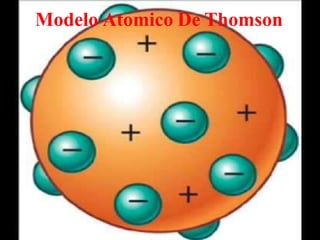
- 3. En Que Consistia El Modelo Atomico •El átomo consistía en una esfera uniforme de materia cargada positivamente en la que se hallaban incrustados los electrones de un modo parecido a como lo están las semillas en una sandía. •Este sencillo modelo explicaba el hecho de que la materia fuese eléctricamente neutra. Pues en los átomos de Thomson la carga positiva era neutralizada por la negativa. Además los electrones podrían ser arrancados de la esfera si la energía en juego era suficientemente importante como sucedía en los tubos de descarga.
- 4. • Si bien el modelo de Thomson explicaba adecuadamente muchos de los hechos observados de la química y los rayos catódicos, hacía predicciones incorrectas sobre la distribución de la carga positiva en el interior de los átomos. • Las predicciones del modelo de Thomson resultaban incompatibles con los resultados del experimento de Rutherford, que sugería que la carga positiva estaba concentrada en una pequeña región en el centro del átomo, que es lo que más tarde se conoció como núcleo atómico. • Otro hecho que el modelo de Thomson había dejado por explicar era la regularidad de la tabla periódica de Mendeleiev.
- 5. Los rayos catódicos: • Los rayos catódicos son corrientes de electrones observados en tubos de vacío, es decir los tubos de cristal que se equipan por lo menos con dos electrodos, un cátodo y un ánodo en una configuración conocida como diodo. Cuando se calienta el cátodo, emite una cierta radiación que viaja hacia el ánodo. Si las paredes internas de vidrio detrás del ánodo están cubiertas con un material fluorescente, brillan intensamente.
- 6. Thomson investigó si podrían ser separadas los electrones de los rayos catódicos y utilizó para ello el medio del magnetismo. Para este experimento construyó un tubo de rayos catódicos el cual al final del tubo termina en dos cilindros con ranuras. Las ranuras fueron conectadas a su vez a un electrómetro Esto llevo a Thomson a la conclusión de que la carga negativa es inseparable de los rayos catódicos. Primer Experimento
- 8. •Para este segundo experimento, JJ Thomson construye un tubo de rayos catódicos, logrando un vacío casi perfecto, en uno de sus extremos lo recubre con pintura fosforescente. La intención del este experimento era investigar si estos rayos podían ser desviados con un campo eléctrico, se conocía que en anteriores experimentos no se habían observado este fenómeno Con la creación de este tubo en el que en uno de sus extremos estaba recubierto con pintura fosforescente, Thomson descubre que muchos rayos si se podían doblar con la influencia de un campo magnetizado. Segundo Experimento
- 10. • Thomson fundamento la relación que hay entre la masa de los rayos catódicos y la carga, para esto mide la cantidad que se desvía por un campo magnético y cuanta cantidad de carga de energía contenida. • La relación masa/carga que encuentra es de un millar de veces superior a la que contiene el ión de Hidrógeno, esto indica que bien las partículas deben ser más livianas o con mucha más carga. • Thomson, a los rayos catódicos que estaban cargados por partículas les llamó “corpúsculos” dichos corpúsculos se originaban dentro de los átomos de los electrodos, a lo que esto significaba, que los átomos deben ser divisibles. • La forma de su explicación de que el átomo esta formado por un núcleo unido y compacto y que en su exterior la denomina como corteza, deja mucha puertas abiertas tanto para Ernest Rutherford o Niels Bohr, quienes continúan con esta investigación dando luz y planteando otras teorías para los átomos y las partes diferenciadas • Tercer experimento
- 12. TRABAJO REALIZADO POR: Elizabeth Orozco Paloma Hernández Edith López Uriel Tolentino Ana Lucia Palafox