Naponski niz metala
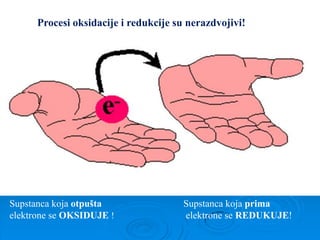
- 1. Supstanca koja otpušta elektrone se OKSIDUJE ! Supstanca koja prima elektrone se REDUKUJE! Procesi oksidacije i redukcije su nerazdvojivi!
- 4. Cu(s) Cu2+ (aq) + 2e- Ako je ravnoteža pomerena na desno - izraženo je rastvaranje metala; površina metala se naelektriše negativno u odnosu na rastvor. Ako je ravnoteža pomerena na levo – joni iz rastvora se redukuju; površina metala se naelektriše pozitivno u odnosu na rastvor. Metal uronjen u rastvor svojih soli, tj. svojih jona predstavlja ELEKTRODU. Zn(s) Zn2+ (aq) + 2e-
- 5. Potencijal izmedju metala i rastvora predstavlja potencijalnu energiju koju u datoj tački polja poseduje jedinično naelektrisanje. Ne može se izmeriti. Naziva se: Oznaka: – javlja se kao posledica oksidoredukcionog procesa koji se odigrava izmedju metala i rastvora. - zavisi od : 1.vrste metala 2. koncentracije jona u rastvoru 3. temperature
- 6. Ako povežemo dve elektrode dobijamo sistem koji se naziva GALVANSKI SPREG.
- 7. Razliku elektrodnih potencijala izmedju elektroda galvanskog sprega možemo izmeriti i ta razlika se naziva galvanskog sprega. STANDARDNI ELEKTRODNI (REDOKS) POTENCIJAL oznaka : E0 je elektromotorna sila galvanskog sprega izmerena pri standardnim uslovima (250C, 101,325 kPa) sa standardnom vodoničnom elektrodom kao jednom od elektroda čiji je elektrodni potencijal proizvoljno uzet da je jednak nuli.
- 9. Pt(s), H2 I H+ (aq) II Cu2+ (aq) I Cu(s) A: H2(g) 2H+ + 2e oksidacija K: Cu2+ + 2e Cu(s) redukcija
- 10. Šta je naponski niz? Ako se metali poređaju u horizontalni niz prema rastućim vrednostima Eo, dobija se ili ili . K Na Mg Al Mn Zn Fe Ni Sn Pb H Cu Ag Hg Au 0- Eo + Eo U naponskom nizu: -redukciona sposobnost opada -oksidaciona sposobnost raste
- 11. OGLED 1 Materijal: hlorovodonična kiselina (1:1), gvozdeni ekser, cink, nikal, mangan, bakarna strugotina, olovo. Pribor: epruvete. Postupak: U epruvete se unesu redom metali i doda se razblažena hloridna kiselina. Posmatrati promene. OGLED 2 Materijal: 20%-tni rastvor sumporne kiseline Pribor: čaša, pipeta, staklena cev sa slavinom, bakarna žica, pločića od cinka, provodnici za spajanje, galvanometaR, stativ sa hvataljkom. Postupak: U čašu sipati 20%-tnu sumpornu kiselinu. U nju uroniti staklenu cev sa slavinom koja je učvršćena hvataljkom za stativ. U proširenje cevi stavi se bakarna spirala, pa se i cev napuni kiselinom. Slavina je zatvorena. Bakar ne reaguje sa kiselinom. Međutim, ako se u rastvor stavi pločica od cinka, pa se oba metala spoje u kolo sa galvanometrom, na bakru će se razvijati vodonik koji se skuplja u staklenoj cevi, a kazaljka na galvanometru pokazuje otklon.
- 12. OGLED 3 Materijal: natrijum-hlorid, magnezijumova traka, bakarna žica, fenolftalein. Pribor: staklena „U“ cev, provodonici, galvanometar, stativ sa hvataljkama. Postupak: Staklena „U“ cev se napuni rastvorom natrijum-hlorida, kojem se doda nekoliko kapi fenolftaleina. U jedan kraj „U“ cevi uroni se bakarna žica, a u drugi komad magezijumove trake. Oba metala se spoje preko galvanometra. Kazaljka galvanometra pokazuje otklon; u kraku „U“ cevi oko bakarne žice pokazuje se ljubičasto obojenje. OGLED 4 Materijal: rastvor srebro-nitrata, bakarno drvo. Pribor: čaša. Postupak: U čašu sipati rastvor srebro-nitrata i uroniti bakarno drvo. Posmatrati promene.
- 13. Određeni metal istiskuje iz vodenih rastvora soli sve metale koji se u naponskom nizu nalaze desno od njega. K Na Mg Al Mn Zn Fe Ni Sn Pb H Cu Ag Hg Au najjača redukciona sredstva najslabija oksidaciona sredstva redukciona sposobnost opada
- 14. 1. Cu2+ + Fe 2. Fe2+ + Cu 3. Zn + Mg2+ 4. Mg + Ni2+ Cu + Fe2+ spontana reakcija nije moguća spontana reakcija nije moguća Mg2+ + Ni Da li je moguća reakcija (ako jeste, dovrši je)?
