Chuong5
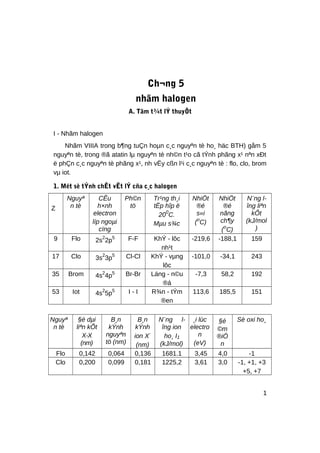
- 1. Ch¬ng 5 nhãm halogen A. Tãm t¾t lÝ thuyÕt I - Nhãm halogen Nhãm VIIIA trong b¶ng tuÇn hoµn c¸c nguyªn tè ho¸ häc BTH) gåm 5 nguyªn tè, trong ®ã atatin lµ nguyªn tè nh©n t¹o cã tÝnh phãng x¹ nªn xÐt ë phÇn c¸c nguyªn tè phãng x¹, nh vËy cßn l¹i c¸c nguyªn tè : flo, clo, brom vµ iot. 1. Mét sè tÝnh chÊt vËt lÝ cña c¸c halogen Z Nguyª n tè CÊu h×nh electron líp ngoµi cïng Ph©n tö Tr¹ng th¸i tËp hîp ë 200 C. Mµu s¾c NhiÖt ®é s«i (o C) NhiÖt ®é nãng ch¶y (o C) N¨ng l- îng liªn kÕt (kJ/mol ) 9 Flo 2s2 2p5 F-F KhÝ - lôc nh¹t -219,6 -188,1 159 17 Clo 3s2 3p5 Cl-Cl KhÝ - vµng lôc -101,0 -34,1 243 35 Brom 4s2 4p5 Br-Br Láng - n©u ®á -7,3 58,2 192 53 Iot 4s2 5p5 I - I R¾n - tÝm ®en 113,6 185,5 151 Nguyª n tè §é dµi liªn kÕt X-X (nm) B¸n kÝnh nguyªn tö (nm) B¸n kÝnh ion X- (nm) N¨ng l- îng ion ho¸ I1 (kJ/mol) ¸i lùc electro n (eV) §é ©m ®iÖ n Sè oxi ho¸ Flo 0,142 0,064 0,136 1681.1 3,45 4,0 -1 Clo 0,200 0,099 0,181 1225,2 3,61 3,0 -1, +1, +3 +5, +7 1
- 2. Brom 0,229 0,114 0,196 1142,2 3,37 2,8 -1, +1, +3 +5, +7 Iot 0,267 0,133 0,220 895,8 3,08 2,5 -1, +1, +3 +5, +7 2. TÝnh chÊt ho¸ häc chung - Líp electron ngoµi cïng gièng nhau : ®Òu cã 7 electron (thiÕu mét electron ®Ó b·o hoµ) vµ ®Òu cã 1 electron ®éc th©n nªn c¸c halogen cã ®Æc ®iÓm gièng nhau vÒ tÝnh chÊt ho¸ häc cña ®¬n chÊt vµ thµnh phÇn, tÝnh chÊt c¸c hîp chÊt. - §i tõ flo ®Õn iot b¸n kÝnh nguyªn tö t¨ng dÇn, ®é ©m ®iÖn gi¶m dÇn nªn kh¶ n¨ng oxi ho¸ gi¶m dÇn : X + 1e → X- II - C¸c ®¬n chÊt halogen Flo Clo Brom Iot T¸c dông víi kim lo¹i 2Fe + 3F2 → 2FeF 3 2Fe + 3Cl2 → 2FeCl3 2Fe + 3Br2 → 2FeB r3 Fe + I2 → FeI2 T¸c dông víi hi®ro F2 + H2 → 2H F Ph¶n øng næ khi chiÕu s¸ng ë nhiÖt ®é th- êng. Cl2 + H2 → 2HCl G©y næ khi trén theo tØ lÖ 1:1 vÒ sè mol vµ chiÕu s¸ng m¹nh Br2+H2 → 2HB r Ph¶n øng còng to¶ nhiÖt nhng kh«ng g©y næ. I2 + H2 2 HI Ph¶n øng thu nhiÖt, thuËn nghÞch, cÇn nhiÖt ®é cao. T¸c dông víi níc vµ dd kiÒm 2F2 + 2H2O → 4HF + O2 2F2 + 2NaOH → Cl2 + H2O HCl + HClO 3Cl2 + 2NaOH → NaCl + NaClO + H2O Br2 + H2O HBr + HBrO Ph¶n øng x¶y ra khã kh¨n h¬n Cl2 I2 + H2O HI + HIO Ph¶n øng x¶y ra rÊt khã kh¨n 2
- 3. 2NaF +OF2 + H2O Cl2 + 6NaOH(®) → 5NaCl + NaClO3 +3H2 O T¸c dông víi muèi cña c¸c haloge n kh¸c F2 + 2NaCl → 2NaF + Cl2 Cl2 + 2NaBr → 2NaCl + Br2 Mét phÇn : 5Cl2 +Br2 + 6H2O → 10HCl + 2HBrO3 Cl2 + 2NaI → 2NaCl + I2 Br2 + 2NaI → NaBr + I2 T¸c dông víi c¸c chÊt khö kh¸c F2 t¸c dông víi nhiÒu chÊt v« c¬ còng nh h÷u c¬ 4F2 + CH4 → CF4 + 4HF Cl2 + SO2 + 2H2O → 2HCl + H2SO4 Br2+SO2+2H2 O → 2HBr + H2SO 4 I2+ 2Na2S2O3 → 2NaI + Na2S4 O6 III - C¸c hîp chÊt cña halogen 1. C¸c hi®ro halogenua (HF, HCl, HBr, HI) §Òu lµ c¸c chÊt khÝ, dÔ tan trong níc t¹o thµnh c¸c dung dÞch axit. 2. C¸c axit halogenhi®ric (HF, HCl, HBr, HI) Trõ HF lµ axit trung b×nh cßn l¹i lµ c¸c axit m¹nh, chóng mang ®Çy ®ñ tÝnh chÊt cña mét axit. 3
- 4. NhËn biÕt c¸c ion halogenua : dïng dung dÞch AgNO3 t¹o thµnh AgCl kÕt rña mµu tr¾ng, AgBr kÕt tña mµu vµng nh¹t, AgI kÕt tña mµu vµng da cam. C¸c muèi nµy ®Òu Ýt bÒn, dÔ bÞ ph©n huû ngoµi ¸nh s¸ng. 2AgBr → 2Ag + Br2 3. C¸c axit chøa oxi Trõ flo kh«ng cã axit chøa oxi, c¸c nguyªn tè cßn l¹i ®Òu cã c¸c axit d¹ng HXO, HXO2, HXO3 vµ HXO4 (X lµ c¸c nguyªn tè Cl, Br, I). HXO, HXO2 lµ c¸c axit yÕu, cßn HXO3 vµ HXO4 lµ c¸c axit m¹nh. B. PhÇn bµi tËp 5.1 CÊu h×nh electron líp ngoµi cïng cña c¸c halogen lµ : A. ns2 np4 ; B. ns2 np5 ; C. ns2 np6 ; D. (n-1)d10 ns2 np5 5.2 CÊu h×nh electron líp ngoµi cïng cña c¸c ion X- cña c¸c halogen lµ : A. ns2 np4 ; B. ns2 np5 ; C. ns2 np6 ; D. (n-1)d10 ns2 np5 5.3 Trong c¸c ®¬n chÊt F2, Cl2, Br2 vµ I2 th× I2 cã nhiÖt ®é nãng ch¶y vµ nhiÖt ®é s«i cao nhÊt v× : A. Do trong tr¹ng th¸i tËp hîp r¾n, láng, khÝ c¸c ph©n tö X2 liªn kÕt víi nhau b»ng lùc Van-®Ðc–Van, lùc nµy phô thuéc vµo ®é dµi liªn kÕt gi÷a hai nguyªn tö. B. Do trong tr¹ng th¸i tËp hîp r¾n, láng, khÝ c¸c ph©n tö X2 liªn kÕt víi nhau b»ng lùc Van-®Ðc–Van, lùc nµy tØ lÖ thuËn víi khèi lîng ph©n tö c¸c chÊt. C. Do trong tr¹ng th¸i tËp hîp r¾n, láng, khÝ c¸c ph©n tö X2 liªn kÕt víi nhau b»ng lùc Van-®Ðc–Van, lùc nµy phô thuéc vµo sè líp electron cña nguyªn tö t¹o nªn c¸c chÊt. 4
- 5. D. Do trong tr¹ng th¸i tËp hîp r¾n, láng, khÝ c¸c ph©n tö X2 liªn kÕt víi nhau b»ng lùc Van-®Ðc–Van, lùc nµy phô thuéc vµo n¨ng lîng liªn kÕt ph©n tö X-X. 5.4 Trong nhãm VIIA tÝnh phi kim cña c¸c nguyªn tè ®i tõ flo ®Õn iot : A. T¨ng dÇn v× n¨ng lîng liªn kÕt trong ph©n tö X–X gi¶m dÇn tõ F– F ®Õn I–I. B. Gi¶m dÇn theo chiÒu t¨ng khèi lîng nguyªn tö tõ F ®Õn I. C. Gi¶m dÇn theo chiÒu t¨ng cña b¸n kÝnh nguyªn tö vµ chiÒu gi¶m dÇn cña ®é ©m ®iÖn. D. T¨ng dÇn theo chiÒu t¨ng cña b¸n kÝnh nguyªn tö vµ ®é ©m ®iÖn gi¶m dÇn. 5.5 Nguyªn tè X cã 11 electron ë c¸c obitan p, ®ã lµ : A. Nguyªn tè Na B. Nguyªn tè F C. Nguyªn tè Br D. Nguyªn tè Cl 5.6 X¸c ®Þnh sè oxi ho¸ cña c¸c nguyªn tè trong c¸c hîp chÊt : HCl, CCl4, NaClO, HClO2, KClO3, KClO4, ClF, BrCl, BrF3, HBrO3, IBr, ICl3, ICl5, IF7. 5.7 Nguyªn tè A cã ho¸ trÞ I t¸c dông hoµn toµn víi canxi thu ®îc 10,0 g muèi, nÕu còng lÊy mét lîng nh trªn nguyªn tè A cho t¸c dông víi nh«m th× thu ®îc 8,9 gam muèi. X¸c ®Þnh nguyªn tè A vµ tÝnh khèi lîng nguyªn tè A ®· ®em sö dông. 5.8 Nguyªn tè X cã ho¸ trÞ kh«ng ®æi t¸c dông hoµn toµn víi magie thu ®- îc 13,80 gam muèi, nÕu còng lÊy mét lîng nh trªn nguyªn tè X cho t¸c dông víi nh«m th× thu ®îc 13,35 gam muèi. X¸c ®Þnh nguyªn tè X vµ tÝnh khèi lîng nguyªn tè X ®· ®em sö dông. BiÕt sè khèi cña X kh«ng vît qu¸ 120u. Khèi lîng X ®· dïng : mBr = 80.0,15 = 12,0 gam. 5.9 Nguyªn tè Y tån t¹i díi d¹ng Y2. Khi lµm th¨ng hoa 1,270 gam Y2 thu ®îc thÓ tÝch 224,0ml ®o ë 273o C vµ 1,0atm. X¸c ®Þnh nguyªn tè Y vµ 5
- 6. viÕt c¸c ph¬ng tr×nh ph¶n øng (nÕu cã) gi÷a Y2 víi s¾t, nh«m, hi®ro vµ oxi. 5.10 Nguyªn tè halogen Y tån t¹i díi d¹ng Y2. Khi cho 16,0 gam Y2 t¸c dông víi mét kim lo¹i kiÒm thu ®îc 23,8 gam muèi. X¸c ®Þnh nguyªn tè Y vµ viÕt c¸c ph¬ng tr×nh ho¸ häc (nÕu cã) gi÷a Y2 víi s¾t, nh«m, hi®ro vµ oxi. 5.11 Nguyªn tè X cã 17 electron ë c¸c obitan p, ®ã lµ : A. Nguyªn tè I B. Nguyªn tè F C. Nguyªn tè Br D. Nguyªn tè Cl 5.12 Trong níc clo cã chøa c¸c chÊt sau : A. HCl, HClO B. HCl, HClO, Cl2 C. HCl, Cl2 D. Cl2 5.13 Hoµ tan khÝ Cl2 vµo dung dÞch KOH ®Æc, nãng cã d thu ®îc dung dÞch chøa: A. KCl, KClO3, Cl2 B. KCl, KClO, KOH C. KCl, KClO3, KOH D. KCl, KClO3 5.14 Hoµ tan khÝ Cl2 vµo dung dÞch NaOH lo·ng, d ë nhiÖt ®é phßng thu ®îc dung dÞch chøa: A. NaCl, NaClO3, Cl2 B. NaCl, NaClO, NaOH C. NaCl, NaClO3, NaOH D. NaCl, NaClO3 5.15 Cã ba lä ®ùng ba khÝ riªng biÖt lµ clo, hi®ro clorua vµ oxi. Cã thÓ dïng mét chÊt nµo trong sè c¸c chÊt sau ®Ó ®ång thêi nhËn biÕt ®îc c¶ ba khÝ ? A. GiÊy quú tÝm tÈm ít B. Dung dÞch Ca(OH)2 C. Dung dÞch BaCl2 D. Dung dÞch H2SO4 6
- 7. 5.16 Cã ba lä ®ùng ba dung dÞch riªng biÖt lµ BaCl2, NaHCO3 vµ NaCl bÞ mÊt nh·n. Cã thÓ dïng mét chÊt nµo trong sè c¸c chÊt sau ®Ó ®ång thêi nhËn biÕt ®îc c¶ ba dung dÞch : A. Dung dÞch Ba(OH)2 B. Dung dÞch NaOH C. Dung dÞch AgNO3 D. Dung dÞch H2SO4 5.17 Trong muèi NaCl cã lÉn NaBr vµ NaI, ®Ó lo¹i hai muèi nµy ra khái NaCl ngêi ta cã thÓ : A. Nung nãng hçn hîp. B. Cho hçn hîp t¸c dông víi dung dÞch HCl ®Æc. C. Cho hçn hîp t¸c dông víi Cl2 sau ®ã ®un nãng. D. C¶ ba ph¬ng ¸n trªn 5.18 §Ó ®iÒu chÕ clo, ngêi ta cã thÓ : A. §iÖn ph©n muèi NaCl nãng ch¶y hoÆc dung dÞch NaCl b·o hoµ cã mµng ng¨n B. Cho KMnO4 hoÆc MnO2 t¸c dông víi dung dÞch HCl ®Æc C. Cho KClO3 t¸c dông víi dung dÞch HCl ®Æc D. C¶ ba ph¬ng ¸n trªn 5.19 §Ó ®iÒu chÕ flo, ngêi ta cã thÓ : A. §iÖn ph©n muèi NaF nãng ch¶y hoÆc dung dÞch NaF trong HF láng. B. Cho KMnO4 hoÆc MnO2 t¸c dông víi dung dÞch HF ®Æc. C. Cho KClO3 t¸c dông víi dung dÞch HF ®Æc. D. C¶ ba ph¬ng ¸n trªn. 5.20 §Ó ®iÒu chÕ khÝ HCl, ngêi ta cã thÓ : A. Cho muèi NaCl t¸c dông víi dung dÞch H2SO4 ®Æc, nãng hay cho Cl2 t¸c dông víi H2 7
- 8. B. Cho dung dÞch BaCl2 t¸c dông víi dung dÞch H2SO4 lo·ng. C. Cho KCl t¸c dông víi dung dÞch KMnO4 cã mÆt dung dÞch H2SO4. D. C¶ ba ph¬ng ¸n trªn. 5.21 §Ó ®iÒu chÕ khÝ HBr, ngêi ta cã thÓ : A. Cho dung dÞch BaBr2 t¸c dông víi dung dÞch H2SO4 lo·ng hay cho Br2 t¸c dông trùc tiÕp víi H2. B. Cho muèi NaBr t¸c dông víi dung dÞch H2SO4 ®Æc. C. Thuû ph©n photpho tribromua. D. C¶ ba ph¬ng ¸n trªn 5.22 §Ó ®iÒu chÕ khÝ HI, ngêi ta cã thÓ : A. Cho dung dÞch BaI2 t¸c dông víi dung dÞch H2SO4 lo·ng. B. Cho muèi NaI t¸c dông víi dung dÞch H2SO4 ®Æc hay cho I2 t¸c dông trùc tiÕp víi H2 C. Thuû ph©n photpho triiotua D. C¶ ba ph¬ng ¸n trªn. 5.23 KhÝ hi®ro thu ®îc b»ng ph¬ng ph¸p ®iÖn ph©n dung dÞch natri clorua ®«i khi bÞ lÉn t¹p chÊt lµ khÝ clo. §Ó kiÓm tra xem khÝ hi®ro cã lÉn khÝ clo hay kh«ng, ngêi ta thæi khÝ ®ã qua mét dung dÞch cã chøa kali iotua vµ hå tinh bét. H·y gi¶i thÝch v× sao ngêi ta l¹i lµm nh vËy. 5.24 Hi®ro florua thêng ®îc ®iÒu chÕ b»ng c¸ch cho axit sunfuric ®Æc t¸c dông víi canxi florua. a) ViÕt c¸c ph¬ng tr×nh ho¸ häc. b) TÝnh khèi lîng canxi florua cÇn dïng ®Ó ®iÒu chÕ 250kg dung dÞch axit flohi®ric 40%. 5.25 §Ó r¨ng ch¾c khoÎ vµ gi¶m bÖnh s©u r¨ng th× hµm lîng flo trong níc cÇn ®¹t lµ 1,0 – 1,5mg/l. H·y tÝnh lîng natri florua cÇn ph¶i pha vµo 8
- 9. trong níc cã s½n hµm lîng flo tõ 0,5mg/l thµnh níc cã hµm lîng flo ®¹t 1,2mg/l ®Ó cung cÊp cho 40 triÖu d©n, mçi ngêi dïng 250 lÝt n- íc/ngµy. Gi¶ sö natri florua kh«ng bÞ thÊt tho¸t trong c¸c qu¸ tr×nh pha trén vµ cung cÊp ®Õn n¬i tiªu dïng. 5.26 §Ó ®iÒu chÕ flo, ngêi ta ph¶i ®iÖn ph©n dung dÞch kali florua trong hi®ro florua láng ®· ®îc lµm s¹ch níc. V× sao ph¶i tr¸nh sù cã mÆt cña níc ? 5.27 Mét chÊt khÝ cã c«ng thøc ph©n tö lµ X2. KhÝ ®ã lµ khÝ nµo ? BiÕt r»ng 1,0 lÝt khÝ ®ã ë ®ktc c©n nÆng 3,1696g. ViÕt c¸c ph¬ng tr×nh ho¸ häc (nÕu cã) cña khÝ X2 víi c¸c chÊt : H2, O2, Cu, Fe, dung dÞch NaOH (ë nhiÖt ®é phßng) vµ níc. 5.28 Cho 4,48 lÝt khÝ Cl2 (®o ë ®ktc) t¸c dông víi H2 d, hÊp thô toµn bé s¶n phÈm vµo níc thu ®îc 100,0ml dung dÞch A. TÝnh nång ®é mol cña dung dÞch A. 5.29 Cho 3,36 lÝt khÝ Cl2 (®o ë ®ktc) t¸c dông víi H2 d, hÊp thô toµn bé s¶n phÈm vµo 100,0ml níc thu ®îc dung dÞch B. TÝnh nång ®é % vµ nång ®é mol cña dung dÞch B. BiÕt khèi lîng riªng cña níc lµ 1,0g/ml vµ cña dung dÞch B lµ 1,132g/ml. 5.30 Mét dung dÞch cã c¸c tÝnh chÊt : - T¸c dông víi nhiÒu kim lo¹i nh Mg, Zn, Fe ®Òu gi¶i phãng hi®ro. - T¸c dông víi baz¬ hoÆc oxit baz¬ t¹o thµnh muèi vµ níc. - T¸c dông víi ®¸ v«i gi¶i phãng khÝ CO2. Dung dÞch ®ã lµ cña chÊt nµo sau ®©y ? A. NaOH ; B. NaCl ; C. HCl ; D. H2SO4 ®Æc, nãng. 5.31 Cã 3 chÊt khÝ ®ùng trong 3 lä riªng biÖt : CO, CO2, Cl2 H·y chøng minh sù cã mÆt cña mçi chÊt khÝ. Nªu c¸ch lµm vµ viÕt c¸c ph¬ng tr×nh hãa häc ®· dïng. 5.32 D·y gåm c¸c chÊt ®Òu ph¶n øng víi dung dÞch HCl lµ : 9
- 10. A - NaOH, Al, CuSO4, CuO B - Cu(OH)2, Cu, CuO, Fe C - CaO, Al2O3, Na2SO4, H2SO4 D - NaOH, Al, CaCO3, Cu(OH)2, Fe, CaO, Al2O3 5.33 Cho 1,20g Mg kim lo¹i ph¶n øng hoµn toµn víi V lÝt khÝ X2 (®o ë ®ktc) thu ®îc 4,75g hîp chÊt MgX2. H·y cho biÕt X2 lµ khÝ nµo vµ tÝnh thÓ tÝch V cña khÝ X2 ®· ph¶n øng víi Mg. 5.34 Mét muèi clorua kim lo¹i chøa 79,775% clo theo khèi lîng. X¸c ®Þnh c«ng thøc ph©n tö cña muèi. ViÕt c¸c ph¬ng tr×nh ho¸ häc ®iÒu chÕ trùc tiÕp muèi trªn tõ c¸c ®¬n chÊt vµ hîp chÊt. 5.35 Cho m gam nh«m vµo trong b×nh kÝn chøa khÝ clo, ®èt nãng ®Ó ph¶n øng x¶y ra hoµn toµn, ®em chÊt r¾n thu ®îc hoµ tan vµo níc thÊy khèi lîng chÊt r¾n kh«ng tan lµ 10g. C« c¹n dung dÞch thu ®îc 26,7g chÊt r¾n khan. TÝnh m vµ khèi lîng clo ®· tham gia ph¶n øng. 5.36 TÝnh lîng clo thu ®îc khi cho 24,5g KClO3 t¸c dông víi dung dÞch HCl ®Æc, d. Lîng clo nµy ph¶n øng ®îc víi bao nhiªu gam s¾t ? 5.37 TÝnh thÓ tÝch khÝ clo thu ®îc ë ®iÒu kiÖn tiªu chuÈn khi ®un nãng nhÑ 3,16g KMnO4 víi dung dÞch axit clohi®ric ®Æc, d. 5.38 CÇn dïng bao nhiªu gam KClO3 t¸c dông víi dung dÞch HCl d ®Ó lîng clo sinh ra ph¶n øng víi dung dÞch KI t¹o ra 38,1g I2 ? 5.39 TÝnh thÓ tÝch khÝ clo thu ®îc ë ®iÒu kiÖn tiªu chuÈn khi ®un nãng nhÑ 3,48g MnO2 víi dung dÞch axit clohi®ric ®Æc, d. Lîng clo nµy ph¶n øng hÕt bao nhiªu gam nh«m kim lo¹i vµ t¹o thµnh bao nhiªu gam muèi khan. 5.40 Mét muèi cã c«ng thøc ph©n tö lµ FeX2 trong ®ã nguyªn tè X chiÕm 55,906% theo khèi lîng. X¸c ®Þnh c«ng thøc ph©n tö cña muèi vµ viÕt 3 ph¬ng tr×nh ph¶n øng trùc tiÕp t¹o thµnh muèi FeX2. 10
- 11. 5.41 Mét muèi cã c«ng thøc ph©n tö lµ FeX3. Cho dung dÞch chøa 3,250g FeX3 t¸c dông víi lîng d dung dÞch AgNO3 thu ®îc 8,610g kÕt tña. X¸c ®Þnh c«ng thøc ph©n tö cña muèi vµ viÕt 3 ph¬ng tr×nh ho¸ häc cña ph¶n øng trùc tiÕp t¹o thµnh muèi FeX3. 5.42 §iÖn ph©n cã mµng ng¨n dung dÞch NaCl b·o hoµ b»ng dßng ®iÖn mét chiÒu thu ®îc 33,6 lÝt khÝ clo ë ®iÒu kiÖn tiªu chuÈn. TÝnh khèi lîng dung dÞch níc Gia - ven thu ®îc khi cho lîng khÝ clo nµy ph¶n øng hoµn toµn víi 600,0g dung dÞch NaOH 20%. 5.43 Hoµ tan hoµn toµn 3,48g MnO2 trong 250,0ml dung dÞch HCl 4M. X¸c ®Þnh nång ®é c¸c chÊt trong dung dÞch thu ®îc (gi¶ sö toµn bé l- îng clo sinh ra ®Òu tho¸t khái dung dÞch vµ thÓ tÝch dung dÞch kh«ng thay ®æi). 5.44 TÝnh khèi lîng KMnO4 cÇn thiÕt ®Ó ®iÒu chÕ lîng clo ®ñ ph¶n øng víi nh«m t¹o thµnh 13,35g muèi AlCl3 (gi¶ sö hiÖu suÊt cña c¸c ph¶n øng ®Òu ®¹t 100%). 5.45 NhiÖt ph©n 31,6g KMnO4 mét thêi gian, thu ®îc hçn hîp r¾n B víi khèi lîng gi¶m 0,8g so víi ban ®Çu. Cho hçn hîp B t¸c dông víi dung dÞch HCl ®Æc, d. - TÝnh % khèi lîng c¸c chÊt trong hçn hîp B. - TÝnh lîng khÝ clo thu ®îc khi B t¸c dông víi dung dÞch HCl ®Æc, d. Lîng clo nµy ph¶n øng hÕt bao nhiªu ml dung dÞch NaOH 0,10M ë nhiÖt ®é phßng. 5.46 §Ó x¸c ®Þnh hµm lîng MnO2 trong hçn hîp bét dïng ®Ó s¶n xuÊt pin, ngêi ta lÊy 25,00g bét nµy cho t¸c dông víi dung dÞch HCl ®Æc, d. L- îng clo sinh ra ph¶n øng võa ®ñ víi dung dÞch chøa 49,8g KI ®Ó t¹o ra I2. TÝnh hµm lîng % MnO2 trong lo¹i bét trªn. 5.47 Khi lµm næ hçn hîp chøa 60% clo vµ 40% hi®ro vÒ thÓ tÝch, hçn hîp thu ®îc ®em dÉn vµo b×nh chøa níc cã s½n mét mÈu giÊy quú tÝm. Nªu hiÖn tîng x¶y ra vµ gi¶i thÝch. 11
- 12. 5.48 Cho mÈu Fe nÆng 7,0g vµo 250ml dung dÞch HCl (dung dÞch A). Sau khi ph¶n øng hoµn toµn thÊy cßn l¹i m gam Fe kh«ng tan. a) Cho m gam Fe trªn vµo 122,5g dung dÞch H2SO4 nång ®é 20% ®Õn khi Fe tan hoµn toµn th× dung dÞch sau ph¶n øng cã nång ®é H2SO4 lµ 15,655%. TÝnh nång ®é dung dÞch B. b) NÕu ®Ó m gam s¾t trªn trong kh«ng khÝ Èm mét thêi gian, thÊy khèi lîng cña nã t¨ng 0,024g. TÝnh % khèi lîng s¾t ®· bÞ oxi ho¸ thµnh oxit (gi¶ sö trong kh«ng khÝ Èm Fe bÞ oxi ho¸ lªn sè oxi ho¸ cao nhÊt). 5.49 Hoµ tan 12,6g hçn hîp hai kim lo¹i ho¸ trÞ II vµ III b»ng dung dÞch axit HCl d thu ®îc dung dÞch A vµ khÝ B. §èt ch¸y hoµn toµn mét nöa khÝ B thu ®îc 2,79g níc. a) Hái khi c« c¹n dung dÞch A thu ®îc bao nhiªu gam muèi khan ? b) §em phÇn 2 cña khÝ B cho ph¶n øng hoµn toµn víi khÝ clo råi cho s¶n phÈm hÊp thô vµo 200,0ml dung dÞch NaOH 16% (d = 1,20g/ml). TÝnh nång ®é % cña c¸c chÊt trong dung dÞch thu ®îc. 5.50 Thªm 16,5ml dung dÞch HCl 20% cã tØ khèi d = 1,106g/ml vµo dung dÞch chøa 51 gam AgNO3. Hái cÇn bao nhiªu ml dung dÞch NaCl nång ®é 13% (cã tØ khèi d = 1,150g/ml ®Ó kÕt tña hoµn toµn AgNO3 cßn l¹i trong dung dÞch. 5.51 TiÕn hµnh ®iÖn ph©n cã mµng ng¨n dung dÞch NaCl b·o hoµ b»ng dßng ®iÖn mét chiÒu thu ®îc 22,4m3 khÝ clo ë ®iÒu kiÖn tiªu chuÈn. TÝnh khèi lîng muèi NaCl ®· ®em ®iÖn ph©n, vµ tÝnh khèi lîng dung dÞch NaOH 40% thu ®îc trong qu¸ tr×nh ®iÖn ph©n. BiÕt hiÖu suÊt thu håi khÝ clo lµ 80%. 5.52 Hoµn thµnh c¸c ph¬ng tr×nh ho¸ häc theo s¬ ®å chuyÓn ho¸ sau : Cl2 → 2H HCl → 2)OH(Ca CaCl2 NaCl → NaCl → NaCl CaCO3 Na → OH2 NaOH → 2CO Na2CO3 12
- 13. 5.53 Cho 10m3 kh«ng khÝ bÞ nhiÔm khÝ clo ®i qua èng chøa KBr d. Khi lîng kh«ng khÝ nµy ®i qua hÕt thÊy khèi lîng chÊt r¾n trong èng thay ®æi 89mg. X¸c ®Þnh hµm lîng clo (mg/m3 ) kh«ng khÝ ®ã. 5.54 §èt 37,90g mét hîp kim gåm Al-Zn trong b×nh ®ùng khÝ clo thu ®îc 59,20g hçn hîp r¾n. Cho hçn hîp r¾n nµy tan hÕt vµo dung dÞch HCl d thu ®îc V (lÝt) khÝ H2 (®kc). DÉn V lÝt khÝ nµy qua èng ®ùng 80g CuO nung nãng, sau mét thêi gian khèi lîng chÊt r¾n trong èng cßn lµ 73,60g vµ chØ cã 80% H2 tham gia ph¶n øng. X¸c ®Þnh thµnh phÇn % khèi lîng Al-Zn trong hîp kim. 5.55 Cho m gam s¾t vµo trong b×nh kÝn chøa khÝ clo, ®èt nãng ®Ó ph¶n øng x¶y ra hoµn toµn, ®em chÊt r¾n thu ®îc hoµ tan vµo níc thÊy khèi lîng chÊt r¾n kh«ng tan lµ 1,0g. C« c¹n dung dÞch thu ®îc 19,05g chÊt r¾n khan. TÝnh m vµ khèi lîng clo ®· tham gia ph¶n øng. 5.56 Ngêi ta n¹p khÝ clo vµ hi®ro vµo trong mét b×nh kÝn cã dung tÝch 4,48 lÝt theo tØ lÖ sè mol Cl2 vµ H2 lµ 2 : 3 trong bãng tèi (ë ®ktc) råi ®a ra ¸nh s¸ng ®Ó ph¶n øng x¶y ra. Sau ph¶n øng, ngêi ta lo¹i bá phÇn clo cha tham gia ph¶n øng, lÊy khÝ hi®ro clorua hoµ tan vµo 100ml níc th× thu ®îc dung dÞch axit clohi®ric nång ®é 1,2M. TÝnh hiÖu suÊt ph¶n øng gi÷a clo vµ hi®ro. 5.57 §Ó x¸c ®Þnh c«ng thøc ph©n tö cña mét muèi kÐp ngËm níc chøa ion kim lo¹i kiÒm, magie vµ clorua ngêi ta tiÕn hµnh thÝ nghiÖm : - Cho 5,55g muèi kÐp t¸c dông víi dung dÞch AgNO3 d t¹o thµnh 8,61g kÕt tña. - Nung nãng 5,55g muèi kÐp ®Õn khèi lîng kh«ng ®æi th× khèi lîng gi¶m 38,92%. ChÊt r¾n thu ®îc hoµ tan vµo lîng d dung dÞch NaOH thÊy cã kÕt tña, läc kÕt tña röa s¹ch, nung ®Õn khèi lîng kh«ng ®æi ®îc 0,8g chÊt r¾n. H·y cho biÕt c«ng thøc ph©n tö cña muèi kÐp ngËm níc nãi trªn. 5.58 Hoµ tan 2,38g KBr vµo 50,0ml dung dÞch níc clo, thÊy dung dÞch n- íc chuyÓn tõ mµu vµng lôc sang mµu vµng n©u. C« c¹n dung dÞch thu 13
- 14. ®îc sau khi ph¶n øng hoµn toµn thÊy cßn l¹i 1,7125g chÊt r¾n khan. Gi¶i thÝch hiÖn tîng vµ tÝnh khèi lîng mçi chÊt trong phÇn r¾n cßn l¹i khi c« c¹n (gi¶ sö clo chØ oxi hãa bromua ®Õn brom). 5.59 Cho 22,0g hçn hîp X gåm Fe vµ Al t¸c dông víi 2,0 lÝt dung dÞch HCl 0,3M thu ®îc V lÝt H2 (®kc). a) Chøng minh hçn hîp X kh«ng tan hÕt. TÝnh V. b) Cho 22,0g hçn hîp X t¸c dông võa ®ñ víi Cl2 thu ®îc m1 gam muèi, cho 22,0g hçn hîp X t¸c dông võa ®ñ víi I2 thu ®îc m2 gam muèi. BiÕt m2-m1=139,3g. TÝnh khèi lîng mçi kim lo¹i trong X. 5.60 Kh«ng dïng thªm thuèc thö, h·y ph©n biÖt c¸c chÊt trong c¸c lä riªng biÖt sau : MgCl2, NaOH, NH4Cl, BaCl2, H2SO4. 5.61 Hçn hîp A gåm NaI, NaCl ®Æt trong èng sø råi nung nãng. Cho mét luång h¬i Br2 ®i qua èng mét thêi gian ®îc hçn hîp muèi B trong ®ã khèi lîng muèi NaCl gÊp 3,9 lÇn khèi lîng muèi NaI. Cho tiÕp mét luång khÝ Cl2 d qua èng ®Õn ph¶n øng hoµn toµn ®îc chÊt r¾n C. NÕu thay Cl2 b»ng F2 d ®îc chÊt r¾n D. Khèi lîng D gi¶m gÊp 2 lÇn so víi khèi lîng C gi¶m (®èi chiÕu víi hçn hîp B). ViÕt c¸c ph¬ng tr×nh ho¸ häc vµ tÝnh thµnh phÇn % khèi lîng c¸c chÊt trong hçn hîp A. 5.62 Ph©n tö MX3 cã tæng sè h¹t proton, n¬tron vµ electron lµ 196, trong ®ã sè h¹t mang ®iÖn nhiÒu h¬n sè h¹t kh«ng mang ®iÖn lµ 60. Sè h¹t mang ®iÖn trong M Ýt h¬n sè h¹t mang ®iÖn trong X lµ 8. - X¸c ®Þnh nguyªn tè M, X vµ vÞ trÝ cña chóng trong BTH. - ViÕt c«ng thøc cÊu t¹o cña MX3 5.63 Hoµ tan hoµn toµn 6,3175g hçn hîp muèi NaCl, KCl vµ MgCl2 vµo níc råi thªm vµo ®ã 100ml dung dÞch AgNO3 1,2M. Sau ph¶n øng läc t¸ch kÕt tña A vµ dung dÞch B. Cho 2,0g Mg vµo dung dÞch B, sau khi ph¶n øng kÕt thóc läc t¸ch riªng kÕt tña C vµ dung dÞch D. Cho kÕt tña C vµo dung dÞch HCl lo·ng d, sau ph¶n øng thÊy khèi lîng C gi¶m 14
- 15. ®i 1,844g. Thªm NaOH d vµo dung dÞch D, läc lÊy kÕt tña nung ®Õn khèi lîng kh«ng ®æi thu ®îc 0,3g chÊt r¾n E. TÝnh khèi lîng c¸c kÕt tña A, C. TÝnh % khèi lîng c¸c muèi trong hçn hîp ban ®Çu. 5.64 Cho khÝ Cl2 t¸c dông víi dung dÞch Ca(OH)2 thu ®îc clorua v«i lµ hçn hîp cña CaCl2, CaOCl2, Ca(ClO)2 vµ níc. Sau khi lo¹i bá níc thu ®îc 152,4g hçn hîp A chøa 50% CaOCl2 ; 28,15% Ca(ClO)2 cßn l¹i lµ CaCl2 (theo khèi lîng). Nung nãng hçn hîp A thu ®îc 152,4g hçn hîp B chØ chøa CaCl2 vµ Ca(ClO3)2. a) TÝnh thÓ tÝch khÝ Cl2 (®ktc) ®· ph¶n øng. b) TÝnh thµnh phÇn % theo khèi lîng CaCl2 trong hçn hîp B. 5.65 ThÓ tÝch khÝ Cl2 cÇn ph¶n øng víi kim lo¹i M b»ng 1,5 lÇn thÓ tÝch khÝ thu ®îc khi cho cïng lîng kim lo¹i M ®ã t¸c dông víi dung dÞch HCl d trong cïng ®iÒu kiÖn. Khèi lîng muèi clorua sinh ra khi t¸c dông víi Cl2 gÊp 1,2886 lÇn khèi lîng muèi sinh ra khi ph¶n øng víi dung dÞch HCl. X¸c ®Þnh M . 5.66 Cho hçn hîp r¾n A gåm KCl vµ KBr t¸c dông víi dung dÞch AgNO3 d. Lîng kÕt tña sinh ra sau khi lµm kh« cã khèi lîng b»ng lîng AgNO3 ®· ph¶n øng. a) X¸c ®Þnh thµnh phÇn % khèi lîng mçi muèi trong hçn hîp A. b) Cho 25,0g hçn hîp A t¸c dông víi 300,0g dung dÞch AgNO3 20%. TÝnh khèi lîng kÕt tña vµ nång ®é % c¸c chÊt tan cßn l¹i trong dung dÞch. 5.67 Mét mÉu Fe ®· bÞ oxi ho¸ mét phÇn thµnh FeO. LÊy 1,2g mÉu nµy cho t¸c dông víi dung dÞch HCl 0,1M thu ®îc 336ml khÝ ë ®ktc. X¸c ®Þnh hµm lîng cña Fe trong mÉu vµ tÝnh thÓ tÝch dung dÞch HCl tèi thiÓu cÇn dïng. 5.68 TÝnh thÓ tÝch khÝ H2 vµ khÝ Cl2 thu ®îc khi ®iÖn ph©n cã mµng ng¨n dung dÞch NaCl ®Ó s¶n xuÊt 1 tÊn dung dÞch NaOH 40%. Lîng 15
- 16. clo nµy cã thÓ s¶n xuÊt ®îc bao nhiªu tÊn níc Gia - ven chøa 5% NaClO ? 5.69 Hoµn thµnh c¸c ph¬ng tr×nh ho¸ häc theo s¬ ®å sau, ghi râ ®iÒu kiÖn (nÕu cã). Trong c¸c ph¶n øng ®ã, ph¶n øng nµo lµ ph¶n øng oxi ho¸ - khö, chØ râ chÊt oxi ho¸, chÊt khö. NaCl → Cl2 → HCl → KCl → Cl2 → Br2 → BaBr2 →HBr → Br2→ I2 5.70 Trong phßng thÝ nghiÖm, ®Ó ®iÒu chÕ Cl2 ngêi ta cho HCl ®Æc, d t¸c dông víi KMnO4 hoÆc MnO2 (®un nãng). a) ViÕt c¸c ph¬ng tr×nh ho¸ häc. b) NÕu dïng cïng mét lîng nh nhau cña KMnO4 hoÆc MnO2 th× trêng hîp nµo cho nhiÒu Cl2 h¬n ? c) Cho HCl ®Æc, d ph¶n øng víi 10,0g hçn hîp KMnO4, MnO2 ®îc 3,36 lit Cl2 (®ktc). TÝnh thµnh phÇn % hçn hîp theo khèi lîng. 5.71 Cho 3,78g Al ph¶n øng võa ®ñ víi dung dÞch XCl3 t¹o thµnh dung dÞch Y vµ chÊt r¾n Z. Khèi lîng dung dÞch Y gi¶m 4,06g so víi dung dÞch XCl3. a) X¸c ®Þnh c«ng thøc cña muèi XCl3. b) Cho dung dÞch Y t¸c dông víi dung dÞch NaOH d, sau ®ã sôc CO2 vµo cho ®Õn khi ph¶n øng kÕt thóc th× thu ®îc m gam kÕt tña. ViÕt c¸c ph¬ng tr×nh ho¸ häc vµ tÝnh m. 5.72 Hçn hîp X chøa Fe vµ kim lo¹i M (cã ho¸ trÞ kh«ng ®æi) víi tØ lÖ sè mol cña M vµ Fe trong X lµ 2 : 3. Chia X lµm 3 phÇn b»ng nhau : - §èt ch¸y hÕt phÇn 1 trong oxi d ®îc 33,4g hçn hîp gåm Fe3O4 vµ oxit cña M. - Hoµ tan phÇn 2 trong dung dÞch HCl thu ®îc 13,44 lÝt khÝ (®ktc) vµ mét dung dÞch trong suèt. - PhÇn 3 t¸c dông hÕt víi 16,8 lÝt khÝ Cl2 (®ktc). a) X¸c ®Þnh kim lo¹i M. 16
- 17. b) TÝnh thµnh phÇn % khèi lîng mçi kim lo¹i trong hçn hîp X. 17
- 18. Ch¬ng 5 nhãm halogen 5.1 §¸p ¸n B. 5.2 §¸p ¸n C. 5.3 §¸p ¸n B. 5.4 §¸p ¸n C. 5.5 §¸p ¸n D 5.6 17 7 15 5 13 3 11251 3 13 3 1111271 4 251 3 231 2 21114 4 11 ;IF;ICl;ICl ;IBr;HBrO;BrF;BrCl;ClF;KClO;KClO;HClO;NaClO;CCl;HCl −+−+−+ −+−++−+−+−+−++−++−++−++−+−+ 5.7 Híng dÉn gi¶i : Gäi sè mol nguyªn tö A ®· tham gia ph¶n øng víi Ca vµ Al lµ x (mol). Ph¬ng tr×nh ho¸ häc : Ca + 2A → CaA2 (1) Al + 3A → AlA3 (2) Ta cã : - Khèi lîng muèi CaA2 : (40 + 2A).x/2 = 10,0 (I) - Khèi lîng muèi AlA3 : (27+ 3A).x/3 = 8,9 (II) Gi¶i hÖ ph¬ng tr×nh (I) vµ (II), thu ®îc : A = 80,0, x = 0,1 mol ⇒ A lµ Br Khèi lîng A ®· dïng : mBr = 80 . 0,1 = 8,0g. 5.8 Híng dÉn gi¶i : Gäi sè mol nguyªn tö X ®· tham gia ph¶n øng víi Mg vµ Al lµ x mol, ho¸ trÞ cña X lµ n vµ nguyªn tö khèi cña X lµ A. Ph¬ng tr×nh ho¸ häc : nMg + 2X → MgnX2 (1) 18
- 19. nAl + 3X → AlnX3 (2) Ta cã : - Khèi lîng muèi MgnX2 : (24n + 2A).x/2 = 13,8 (I) - Khèi lîng muèi AlnX3 : (27n+ 3A).x/3 = 13,35 (II) Gi¶i hÖ ph¬ng tr×nh (I) vµ (II), thu ®îc : A = 80,0n < 120 ⇒ n = 1mol vµ A = 80 ⇒ X lµ Br vµ x = 0,15. Khèi lîng X ®· dïng : mBr = 80 . 0,15 = 12,0g. 5.9 Híng dÉn gi¶i : - Sè mol Y2 : 2Y PV n RT = = 0,005mol, khèi lîng mol ph©n tö Y2 : 254g, khèi lîng mol nguyªn tö Y : 127g ⇒ Nguyªn tè Y lµ iot (I). - C¸c ph¬ng tr×nh ho¸ häc cña I2 víi c¸c chÊt : * I2 + Fe → FeI2 * 3I2 + 2Al → 2AlI3 * I2 + H2 2HI * I2 + O2 → kh«ng ph¶n øng 5.10 Híng dÉn gi¶i : Gäi sè mol Y2 trong 16,0g lµ a, kim lo¹i kiÒm lµ M 2M + Y2 → 2MY 2a a 2a - Khèi lîng Y2 : 2Ya = 16,0 ⇒ Ya = 8,0 - Khèi lîng MY : (M + Y) . 2a = 23,8 ⇒ Ma = 3,9 ⇒ Ma : Ya = M : Y = 39 : 80. VËy Y lµ brom vµ M lµ kali. - C¸c ph¬ng tr×nh ho¸ häc gi÷a Br2 víi c¸c chÊt : * 3Br2 + 2Fe → 2FeBr3 19
- 20. * 3Br2 + 2Al → 2AlBr3 * Br2 + H2 2HBr * Br2 + O2 → kh«ng ph¶n øng 5.11 §¸p ¸n C. 5.12 §¸p ¸n B. 5.13 §¸p ¸n C. 5.14 §¸p ¸n B. 5.15 §¸p ¸n A. - KhÝ lµm cho mÈu giÊy quú tÝm ít chuyÓn sang mµu ®á, sau ®ã lµm mÊt mµu lµ khÝ clo. + KhÝ clo tan trong níc : Cl2 + H2O → HCl + HClO + Axit HCl t¹o ra lµm ®á quú tÝm. + Axit HClO t¹o ra cã tÝnh oxi ho¸ m¹nh cã tÝnh tÈy mµu lµm mÊt mµu giÊy quú. - KhÝ lµm cho mÈu giÊy quú tÝm ít chuyÓn sang mµu ®á lµ khÝ hi®ro clorua. - KhÝ kh«ng t¹o ra hiÖn tîng g× lµ oxi. 5.16 §¸p ¸n D. - Dung dÞch t¹o kÕt tña tr¾ng lµ dung dÞch BaCl2 : BaCl2 + H2SO4 → 2HCl + BaSO4↓ - Dung dÞch t¹o chÊt khÝ bay ra lµ dung dÞch NaHCO3 : 2NaHCO3 + H2SO4 → Na2SO4 + CO2↑ + H2O - Dung dÞch kh«ng cã hiÖn tîng g× lµ dung dÞch NaCl. 5.17 §¸p ¸n C. 5.18 §¸p ¸n D. 5.19 §¸p ¸n A. 5.20 §¸p ¸n A. 20
- 21. 5.21 §¸p ¸n C. 5.22 §¸p ¸n C. 5.23 Híng dÉn gi¶i : 2KI + Cl2 → 2KCl + I2 I2 lµm xanh dung dÞch hå tinh bét. 5.24 Híng dÉn gi¶i : a) CaF2 + H2SO4→ CaSO4 + 2HF↑ b) Khèi lîng CaF2 cÇn dïng : m = 195kg. 5.25 §¸p sè : Khèi lîng NaF cÇn dïng lµ m = 7 000kg. 5.26 Híng dÉn gi¶i : V× 2F2 + 2H2O → 4HF + O2 5.27 Híng dÉn gi¶i : KhÝ clo. - C¸c ph¬ng tr×nh ho¸ häc cña Cl2 víi c¸c chÊt : * Cl2 + H2 → 2HCl * Cl2 + O2 → kh«ng ph¶n øng * Cl2 + Cu → CuCl2 * 3Cl2 + 2Fe → 2FeCl3 * Cl2 + 2NaOH → NaCl + NaClO + H2O * Cl2 + H2O → HCl + HClO 5.28 §¸p ¸n : Nång ®é HCl trong dung dÞch thu ®îc CHCl = 4,0M. 5.29 Híng dÉn gi¶i : - Sè mol Cl2 : 15,0 4,22 36,3 n 2Cl == (mol) - Ph¬ng tr×nh hãa häc: Cl2 + H2 → 2HCl - Sè mol HCl : nHCl = 0,15 . 2 = 0,30(mol) - Khèi lîng dung dÞch B : mB = 100,0 . 1,0 + 36,5 . 0,30 = 110,95(g). 21
- 22. - ThÓ tÝch dung dÞch B : VB = == 132,1 95,110 D m 98,0(ml) - Nång ®é % cña dung dÞch B : C%HCl = %100. 95,110 5,36.3,0 %100. m m B HCl = = 9,87% - Nång ®é mol cña dung dÞch B : CM = 098,0 3,0 V n B HCl = = 3,06(M). 5.30 §¸p ¸n C. 5.31 Híng dÉn gi¶i : - Cho ba khÝ ®i tõ tõ qua ba cèc níc chøa mÈu giÊy quú tÝm, cèc nµo lµm mÈu giÊy quú ho¸ ®á sau mÊt mµu chøng tá khÝ ®ã lµ Cl2 : * Cl2 + H2O → HCl + HClO HCl lµm ®á quú tÝm, sau ®ã HClO lµm mÊt mµu mÈu giÊy quú. - DÉn hai khÝ cßn l¹i qua hai cèc chøa dung dÞch Ca(OH)2 d, cèc nµo cã kÕt tña xuÊt hiÖn chøng tá khÝ ®ã lµ CO2 : CO2 + Ca(OH)2 → CaCO3↓ + H2O - KhÝ cßn l¹i ®em ®èt ch¸y råi dÉn qua dung dÞch Ca(OH)2 d, kÕt tña xuÊt hiÖn chøng tá khÝ ®ã lµ CO : 2CO + O2 → 2CO2 5.32 §¸p ¸n D. 5.33 §¸p ¸n : KhÝ X2 lµ Cl2, V = 1,120 lÝt. 5.34 Híng dÉn gi¶i : - Gäi kim lo¹i lµ M, hãa trÞ cña kim lo¹i lµ n, c«ng thøc cña muèi lµ MCln - Thµnh phÇn % khèi lîng cña M trong muèi lµ : %mM = 100% - 79,775% = 20,225% - Ta cã : 225,20 775,79 M n5,35 = ⇒ M = 9n. 22
- 23. VËy kÕt qu¶ phï hîp lµ n = 3 vµ M = 27 (Al), c«ng thøc cña muèi lµ : AlCl3. - C¸c ph¬ng tr×nh hãa häc ®iÒu chÕ trùc tiÕp AlCl3 : + 2Al + 3Cl2 → 2AlCl3 + 2Al + 6HCl → 2AlCl3 + 3H2 + Al2O3 + 6HCl → 2AlCl3 + 3H2O + Al(OH)3 + 3HCl → AlCl3 + 3H2O + Al2(SO4)3 + 3BaCl2 → 2AlCl3 + 3BaSO4↓ 5.35 §¸p ¸n : Khèi lîng nh«m ®· lÊy : mAl = 15,4g, Khèi lîng clo : =2Clm 21,3g. 5.36 §¸p ¸n : Khèi lîng clo : =2Clm 42,6g, Khèi lîng s¾t ph¶n øng : mFe = 22,4g. 5.37 §¸p ¸n : ThÓ tÝch khÝ clo thu ®îc ë ®ktc: 2ClV = 1,12 lÝt. 5.38 §¸p ¸n : Khèi lîng kali clorat : =3KClOm 6,125g. 5.39 §¸p ¸n : ThÓ tÝch clo thu ®îc : =2ClV 0,896 lÝt ; khèi lîng nh«m ph¶n øng mAl = 0,72g ; khèi lîng muèi t¹o thµnh : =3AlClm 3,56g. 5.40 Híng dÉn gi¶i : - Ta cã : )%9,55100( %9,55 56 X2 m% m% Fe X − == ⇒ X = 35,5; VËy X lµ clo vµ muèi lµ FeCl2. - C¸c ph¬ng tr×nh ph¶n øng t¹o thµnh FeCl2 : Fe + 2HCl → FeCl2 + H2 Fe + CuCl2 → FeCl2 + Cu 23
- 24. Fe + 2FeCl3 → 3FeCl2 5.41 Híng dÉn gi¶i : - Gäi sè mol FeX3 trong 3,250g lµ a. FeX3 + 3AgNO3 → 3AgCl↓ + Fe(NO3)3 - Sè mol AgCl = 3a = = 5,143 61,8 0,06(mol) ⇒ a = 0,02(mol). - Khèi lîng mol ph©n tö cña FeX3 = 56 + 3X = 02,0 250,3 = 162,5(g) ⇒ X = 35,5 ; VËy X lµ clo vµ muèi lµ FeCl3. - C¸c ph¬ng tr×nh ho¸ häc t¹o thµnh FeCl3 : 2Fe + 3Cl2 → 2FeCl3 2FeCl2 + Cl2 → 2FeCl3 Fe2(SO4)3 + 3BaCl2 → 2FeCl3 + 3BaSO4↓ 5.42 §¸p sè : Khèi lîng dung dÞch níc Gia-ven thu ®îc lµ 606,5g. 5.43 §¸p sè : Nång ®é c¸c chÊt trong dung dÞch CHCl = 3,36M ; 2MnClC = 0,16M. 5.44 §¸p sè : Khèi lîng KMnO4 cÇn : 4KMnOm = 9,48g. 5.45. Híng dÉn gi¶i : - Ph¶n øng nhiÖt ph©n : 2KMnO4 → 0 t K2MnO4 + MnO2 + O2↑ - Theo ph¬ng tr×nh ho¸ häc, khèi lîng chÊt r¾n gi¶m ®i b»ng lîng oxi tho¸t ra : 2 2O O 0,8 m 0,8 n 32 = =g; = 0,025mol - Sè mol KMnO4 ®· bÞ nhiÖt ph©n lµ : 2 . 0,025 = 0,050mol ; - Sè mol KMnO4 cßn l¹i = 158 6,31 - 0,05 = 0,15mol 24
- 25. - Sè mol MnO2 vµ sè mol K2MnO4 t¹o thµnh = sè mol O2 = 0,025mol - PhÇn tr¨m khèi lîng hçn hîp B : 4 2 4 2 158.0,15 % .100% 76,95% 31,6 0,8 197.0,025 % .100% 15,99% 31,6 0,8 87.0,025 % .100% 7,06% 31,6 0,8 KMnO K MnO MnO m m m = = − = = − = = − - Cho hçn hîp B t¸c dông víi dung dÞch HCl ®Æc : 2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O (1) K2MnO4 + 8HCl → MnCl2 + 2KCl + 2Cl2 + 4H2O (2) MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (3) Sè mol Cl2 sinh ra : =++= 242 4 2 MnOMnOK KMnO Cl nn2 2 n5 n 0,45mol - Khèi lîng Cl2 sinh ra : 2Clm 71.0,45 31,95 ;= = g - Cho Cl2 t¸c dông víi dung dÞch NaOH ë nhiÖt ®é phßng : Cl2 + 2NaOH → NaCl + NaClO + H2O Sè mol NaOH tham gia ph¶n øng : nNaOH = 2 =2Cln 2 . 0,45 = 0,9mol - ThÓ tÝch dung dÞch NaOH ®· dïng : VNaOH = 1,0 9,0 C n M NaOH = = 1,0 lÝt = 1000ml. 5.46 Híng dÉn gi¶i : Gäi sè mol MnO2 trong 25,00g hçn hîp bét lµ a. Cho hçn hîp bét t¸c dông víi dung dÞch HCl ®Æc, d : MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O (1) Lîng Cl2 sinh ra cho t¸c dông víi dung dÞch KI : Cl2 + 2KI → 2KCl + I2 (2) 25
- 26. Theo c¸c ph¬ng tr×nh (1) vµ (2) : a = 15,0 2.166 8,49 2 nKI == (mol) Hµm lîng MnO2 trong hçn hîp bét : %20,52%100. 00,25 15,0.87 m% 2MnO == 5.47 Híng dÉn gi¶i : HiÖn tîng : MÈu giÊy quú tÝm hãa ®á sau ®ã mÊt mµu. Gi¶i thÝch : Trong hçn hîp chøa 60% clo vµ 40% hi®ro vÒ thÓ tÝch nªn sè mol clo lín h¬n sè mol hi®ro. Khi clo t¸c dông hoµn toµn víi hi®ro th× hçn hîp thu ®îc gåm HCl vµ Cl2 d. Cl2 + H2 → 2HCl Hßa tan hçn hîp s¶n phÈm vµo níc, khÝ HCl tan t¹o thµnh axit HCl lµm ®á giÊy quú tÝm. Lîng clo d t¸c dông víi H2O t¹o thµnh HClO cã tÝnh tÈy mµu nªn lµm mÊt mµu mÈu giÊy quú tÝm. Cl2 + H2O → HCl + HClO 5.48 Híng dÉn gi¶i : a) Fe t¸c dông víi dung dÞch HCl : Fe + 2HCl → FeCl2 + H2 (1) - Sè mol H2SO4 : 25,0 %100.98 %20.5,122 n 42SOH == mol - Gäi sè mol Fe trong m gam lµ a : Fe + H2SO4 → FeSO4 + H2 (2) - Nång ®é H2SO4 trong dung dÞch thu ®îc : %655,15%100. a2a565,122 )a25,0.(98 %C = −+ − = ⇒ a = 0,05mol - Sè mol Fe ®· tham gia ph¶n øng víi HCl : nFe = 05,0 56 0,7 − = 0,075mol - Nång ®é dung dÞch HCl : ==== 25,0 075,0.2 V n2 V n C FeHCl HCl 0,6M. b) §Ó m gam s¾t trong kh«ng khÝ Èm mét thêi gian : 26
- 27. 4Fe + 3O2→ 2Fe2O3 (3) - Khèi lîng mÈu s¾t t¨ng ®óng b»ng lîng O2 tham gia ph¶n øng : 2 2O O 0,024 m 0,024 n 32 = =g ; = 7,5.10-4 (mol) - Sè mol Fe bÞ oxi hãa : nFe = 3O 10.1 3 n4 2 − = (mol) - PhÇn tr¨m Fe ®· bÞ oxi hãa : %100. 05,0.56 10.56 m% 3 Fe − = = 2,0% 5.49 Híng dÉn gi¶i : a) Gäi kim lo¹i hãa trÞ II lµ M cã a mol trong hçn hîp, kim lo¹i hãa trÞ III lµ M’ cã b mol trong hçn hîp. Ta cã c¸c ph¬ng tr×nh ho¸ häc : M + 2HCl → MCl2 + H2 (1) a a a 2M’ + 6HCl → 2M’Cl3 + 3H2 (2) b b 3b 2 2H2 + O2 → 2H2O (3) 1 3b . a 2 2 + ÷ 1 3b . a 2 2 + ÷ Theo c¸c ph¬ng tr×nh tõ (1) ®Õn (3) : += 2 b3 a. 2 1 .18m OH2 =2,79g ⇒ 2a + 3b = 0,62 mol Sè mol nguyªn tö Cl tham gia ph¶n øng t¹o muèi = 2a + 3b mol; ⇒ Khèi lîng hçn hîp muèi thu ®îc : mmuèi = mkim lo¹i + mCl = 12,6 + 35,5 . 0,62 = 34,61g. b) PhÇn 2 cho t¸c dông víi Cl2 : H2 + Cl2 → 2HCl Sè mol HCl t¹o thµnh : 2a + 3b = 0,62 mol Hoµ tan HCl vµo 200,0ml dung dÞch NaOH 16% (d = 1,20g/ml): 27
- 28. NaOH NaOH V.d.C% 200,0.1,20.16 n 100%.M 100.40 = = = 0,96 mol HCl + NaOH → NaCl + H2O 0,62 0,96 mol 0 0,34 0,62 mol Khèi lîng dung dÞch t¹o thµnh : mdd = 200,0.1,2 + 36,5.0,62 = 262,63 gam Nång ®é c¸c chÊt trong dung dÞch thu ®îc : C%NaCl = 58,5.0,62 .100% 262,63 = 13,81% C%NaOH = 40.0,34 .100% 262,63 = 5,18% 5.50 §¸p sè : ThÓ tÝch dung dÞch NaCl 13% cÇn lÊy lµ VNaOH = 78,26ml. 5.51 §¸p sè : Khèi lîng muèi NaCl ®· dïng lµ : mNaCl = 146,25kg. Khèi lîng dung dÞch NaOH 40% thu ®îc lµ m = 250,0kg. 5.52 C¸c ph¬ng tr×nh ho¸ häc : 2NaCl 2Na + Cl2 Cl2 + 2Na → 2NaCl Cl2 + H2 → 2HCl 2Na + 2H2O → 2NaOH + H2 HCl + NaOH → NaCl + H2O 2HCl + Ca(OH)2 → CaCl2 + 2H2O CO2 + 2NaOH → Na2CO3 + H2O Na2CO3 + CaCl2 → CaCO3 + 2NaCl 5.53 §¸p sè : Hµm lîng clo trong kh«ng khÝ : 7,1mg/m3 . 5.54 Híng dÉn gi¶i : Gäi sè mol Al vµ Zn trong 37,90g hîp kim lµÇ vµ b. 28 §iÖn ph©n nãng ch¶y
- 29. 2Al + 3Cl2 → 2AlCl3 (1) Zn + Cl2 → ZnCl2 (2) 2Al + 6HCl → 2AlCl3 + 3H2 (3) Zn + 2HCl → ZnCl2 + H2 (4) CuO + H2 → o t Cu + H2O (5) Gäi sè mol Al tham gia ph¶n øng víi clo lµ a1, Zn tham gia ph¶n øng víi clo lµ b1. Gäi sè mol Al tham gia ph¶n øng víi HCl lµ a2, Zn tham gia ph¶n øng víi HCl lµ b2. Sè mol Cl2 ®· ph¶n øng lµ 1,5a1 + b1; sè mol H2 sinh ra lµ 1,5a2 + b2. Sè mol Cl2 tham gia ph¶n øng (1) vµ (2) lµ : 30,0 71 90,3720,59 ba5,1n 11Cl2 = − =+= (mol) (I) Sè mol H2 tham gia ph¶n øng (5) lµ : 40,0 16 60,7300,80 n 2H = − = (mol) Sè mol H2 sinh ra lµ : 1,5a2 + b2 = 50,0 %80 %100.40,0 = (mol) (II) Tõ (I) vµ (II) ⇒ 1,5(a1 + a2) + (b1+ b2) = 1,5a + b = 0,80 (III) Khèi lîng hîp kim : m = 27a + 65b = 37,9 (IV) Gi¶i hÖ ph¬ng tr×nh (III) vµ (IV), thu ®îc : a = 0,20mol, b = 0,50mol Hµm lîng mçi kim lo¹i trong hîp kim : %75,85%100. 9,37 50,0.65 m% %25,14%100. 9,37 20,0.27 m% Zn Al == == 5.55 Híng dÉn gi¶i : - Ph¶n øng gi÷a Fe vµ Cl2 : 2Fe + 3Cl2 → 2FeCl3 (1) 29
- 30. - Khi hßa tan s¶n phÈm vµo níc thÊy cßn 1,0g chÊt r¾n kh«ng tan ⇒ Fe d. V× vËy ta cã : Fe + 2FeCl3 → 3FeCl2 (2) - Khèi lîng chÊt r¾n thu ®îc khi c« c¹n dung dÞch : 05,19x127m 2FeCl == g ⇒ x = 0,15mol - Khèi lîng Fe ®· dïng : m = 1,0 + 56 . 0,15 = 9,4g - Khèi lîng Cl2 ®· ph¶n øng : 2Clm 71x= = 71 . 0,15 = 10,65g 5.56 §¸p sè : HiÖu suÊt ph¶n øng H% = 75%. 5.57 Híng dÉn gi¶i : Gäi c«ng thøc ph©n tö cña muèi kÐp lµ xMCl.yMgCl2.nH2O cã a mol trong 5,55g. - Cho muèi t¸c dông víi dung dÞch AgNO3 d : xMCl.yMgCl2.nH2O +(x+2y)AgNO3→ (x+2y)AgCl↓+xMNO3+yMg(NO3)2+ nH2O a mol (x+2y)a mol Khèi lîng kÕt tña : m = 143,5(x + 2y).a = 8,61 ⇒ xa + 2ya = 0,06(mol) (I) - Nung nãng muèi ®Õn khèi lîng kh«ng ®æi th× khèi lîng lµ níc : xMCl.yMgCl2.nH2O → o t xMCl.yMgCl2 + nH2O a a na Ta cã : %92,38%100. 55,5 na18 = ⇒ na = 0,12mol - Cho phÇn r¾n sau khi nung hßa tan vµo dung dÞch NaOH, chØ cã Mg(OH)2 kÕt tña. MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl ya ya Mg(OH)2 → o t MgO + H2O ya ya 30
- 31. Ta cã : 40ya = 0,8g ⇒ ya = 0,02mol. Tõ (I) ⇒ xa = 0,02mol. MÆt kh¸c : mmuèi = [(M+35,5)x + 95y + 18n]a = 5,55 vµ x:y:n = xa:ya:na = 1:1:6, chän x = y = 1 ⇒ M = 39. C«ng thøc ph©n tö cña muèi lµ : KCl.MgCl2.6H2O. 5.58 Híng dÉn gi¶i : - Dung dÞch chuyÓn tõ mµu vµng lôc sang vµng n©u do : 2KBr + Cl2 (vµng lôc) → 2KCl + Br2 (n©u) - Theo ph¬ng tr×nh ho¸ häc, mçi mol KBr ph¶n øng t¹o thµnh KCl th× khèi lîng muèi gi¶m 44,5g ⇒ Sè mol KBr ph¶n øng t¹o thµnh KCl = 5,44 7125,138,2 − = 0,015(mol) - Thµnh phÇn hçn hîp muèi thu ®îc khi c« c¹n : mKCl = 1,1175g ; mKBr = 0,595g. 5.59 Híng dÉn gi¶i : a) Sè mol HCl : nHCl = 0,30 . 2,0 = 0,60(mol). Gäi sè mol Al vµ Fe trong 22,0g hçn hîp X lµ a vµ b. Ta cã : 27a + 56b = 22,0 (I) Cho hçn hîp X t¸c dông víi dung dÞch HCl : 2Al + 6HCl → 2AlCl3 + 3H2 (1) Fe + 2HCl → FeCl2 + H2 (2) Tõ (1) vµ (2), ta cã sè mol HCl ph¶n øng : nHCl = 3nAl + 2nFe = 0,60mol Tõ (I) ta cã : 28(3a + 2b) – 57a = 22,0 ⇒ 3a + 2b > 0,785 > 0,06. VËy hçn hîp kim lo¹i kh«ng tan hÕt, do ®ã HCl ph¶n øng hoµn toµn : 2 60,0 2 n n HCl H2 == = 0,30(mol) == 30,0.4,22V 2H 6,72 lÝt. 31
- 32. b) Cho 22,0g hçn hîp X t¸c dông víi Cl2 : 2Al + 3Cl2 → 2AlCl3 (3) 2Fe + 3Cl2 → 2FeCl3 (4) m1 = 133,5a + 162,5b Cho 22,0g hçn hîp X t¸c dông víi I2 : 2Al + 3I2 → 2AlI3 (5) Fe + I2 → FeI2 (6) m2 = 408a + 310b Ta cã m2 – m1 = 274,5a + 147,5b = 139,3 (II) Gi¶i hÖ ph¬ng tr×nh (I) vµ (II), thu ®îc : a = 0,40mol, b = 0,20mol Khèi lîng Al, Fe trong hçn hîp X : mAl = 27a = 10,8g ; mFe = 56b = 11,2g. 5.60 Híng dÉn gi¶i : - TrÝch c¸c mÉu thö vµo c¸c èng nghiÖm cã ®¸nh sè, sau ®ã lÇn lît cho c¸c dung dÞch t¸c dông víi c¸c mÉu thö cßn l¹i, ta tæng hîp kÕt qu¶ theo b¶ng sau : MgCl2 NaOH NH4Cl BaCl2 H2SO4 MgCl2 0 ↓ - - - NaOH ↓ 0 ↑mïi khai - - NH4Cl - ↑mïi khai 0 - - BaCl2 - - - 0 ↓ H2SO4 - - - ↓ 0 - Dung dÞch nµo t¹o ®îc mét kÕt tña vµ khÝ cã mïi khai bay ra lµ dung dÞch NaOH, dung dÞch nµo t¹o kÕt tña tr¾ng víi dung dÞch NaOH lµ dung dÞch MgCl2 cßn dung dÞch cho khÝ mïi khai tho¸t ra lµ dung dÞch NH4Cl. 2NaOH + MgCl2 → 2NaCl + Mg(OH)2↓tr¾ng 32
- 33. NaOH + NH4Cl → NaCl + NH3 ↑mïi khai + H2O - Chia kÕt tña Mg(OH)2 lµm hai phÇn, lÇn lît cho hai dung dÞch cßn l¹i t¸c dông víi mçi phÇn, dung dÞch nµo hßa tan ®îc Mg(OH)2 lµ dung dÞch H2SO4, dung dÞch cßn l¹i lµ dung dÞch BaCl2. Mg(OH)2 + H2SO4 → MgSO4 + 2H2O 5.61 Híng dÉn gi¶i : - Khi cho h¬i brom ®i qua hçn hîp A : 2NaI + Br2 → 2NaBr + I2 (1) Hçn hîp B gåm : x mol NaCl, y mol NaBr vµ z mol NaI d. Ta cã : 58,5x = 3,9 . 150z ⇒ x = 10z (I) - Khi cho h¬i clo d ®i qua hçn hîp B : 2NaI + Cl2 → 2NaCl + I2 (2) 2NaBr + Cl2 → 2NaCl + Br2 (3) ChÊt r¾n C : NaCl (x + y + z) mol - Khi cho h¬i flo d ®i qua hçn hîp B : 2NaI + F2 → 2NaF + I2 (4) 2NaBr + F2 → 2NaF + Br2 (5) 2NaCl + F2 → 2NaCl + Br2 (6) ChÊt r¾n D : NaF (x + y + z)mol Ta cã : mB – mD = 2(mB – mC) ⇒ 58,5x + 103y + 150z – 42(x + y + z) = 2[58,5x + 103y + 150z – 58,5(x + y + z)] ⇒ 61y + 273z = 89y + 183z ⇒ y = 14 45 z mol Hçn hîp A : NaCl x = 10z mol ; NaI (y + z) = 14 59 mol. 33
- 34. %94,51%100. z10.5,58 14 59 .150 z 14 59 .150 m% %06,48%100. z10.5,58 14 59 .150 z10.5,58 m% NaI NaCl = + = = + = 5.62 Híng dÉn gi¶i : - Sè proton, electron, n¬tron trong M vµ X lÇn lît lµ P1, E1, N1 vµ P2, E2, N2. Ta cã : (P1+ E1+ N1) + 3(P2+ E2+ N2) = 196 (I) (P1+ E1) + 3(P2+ E2) – (N1+ 3N2) = 60 (II) Gi¶i hÖ ph¬ng tr×nh (I) vµ (II), thu ®îc : (P1+ E1) + 3(P2+ E2) = 128, (N1+ 3N2) = 68 MÆt kh¸c : (P2+ E2) - (P1+ E1) = 8 ⇒ P1 = E1 = 13, P2 = E2 = 17. VËy M lµ Al, X lµ Cl, c«ng thøc cña hîp chÊt : AlCl3 cã c«ng thøc cÊu t¹o : 5.63 Híng dÉn gi¶i : Gäi sè mol NaCl, KCl vµ MgCl2 trong 6,3175g hçn hîp muèi lµ x, y vµ z. - Sè mol AgNO3 ban ®Çu : 0,1 . 1,2 = 0,12(mol). - Cho hßa tan hçn hîp vµo dung dÞch AgNO3, cã c¸c ph¶n øng : NaCl + AgNO3 → AgCl↓ + NaNO3 (1) KCl + AgNO3 → AgCl↓ + KNO3 (2) 34 Cl – Al - Cl | Cl
- 35. MgCl2 + 2AgNO3 → 2AgCl↓ + Mg(NO3)2 (3) Khi cho 2,0g Mg vµo dung dÞch B, Mg chØ t¸c dông víi AgNO3 (nÕu d- ), v× vËy trong kÕt tña C cã thÓ cã Ag vµ Mg. MÆt kh¸c kÕt tña C tan mét phÇn trong dung dÞch HCl, nªn trong kÕt tña C cßn Mg d, lîng Mg d t¸c dông víi HCl nªn lµm khèi lîng kÕt tña gi¶m, nhng khèi lîng gi¶m lµ 1,844g < 2,0g chøng tá mét phÇn Mg ®· ph¶n øng víi AgNO3 d. VËy c¸c muèi clorua kÕt tña hoµn toµn víi AgNO3. - Dung dÞch B ph¶n øng víi Mg : 2AgNO3 + Mg → 2Ag↓ + Mg(NO3)2 (4) - KÕt tña C gåm Mg d vµ Ag cho t¸c dông víi dung dÞch HCl : chØ cã Mg ph¶n øng. Mg + 2HCl → MgCl2 + H2 (5) Lîng Mg tan b»ng lîng Mg d, do ®ã lîng Mg tham gia ph¶n øng (4) lµ : 2,0 – 1,844 = 0,156(g) Ta cã sè mol AgNO3 : 12,0 24 156,0 2z2yxn 3AgNO =+++= (mol) (I) - Dung dÞch D chøa Mg(NO3)2 : z + 24 156,0 = z + 0,0065 (mo)l vµ HCl d, khi cho t¸c dông víi dung dÞch NaOH d : HCl + NaOH → NaCl + H2O (6) MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl (7) - §em kÕt tña nung tíi khèi lîng kh«ng ®æi : Mg(OH)2 → o t MgO + H2O (8) Theo c¸c ph¬ng tr×nh trªn, ta cã : nMgO = z + 0,0065 = 40 3,0 = 0,0075(mol) ⇒ z = 0,001(mol). - Khèi lîng hçn hîp muèi ban ®Çu : 35
- 36. m = 28,5x + 74,5y + 95z = 6,3175 (II) Thay z vµo ph¬ng tr×nh (I) vµ (II), gi¶i hÖ ph¬ng tr×nh thu ®îc : x = 0,10mol, y = 0,005mol. Khèi lîng kÕt tña A : mA = 143,5(x + y +2z) = 15,3545(g) PhÇn tr¨m c¸c muèi trong hçn hîp ®Çu : %5,1%100. 3175,6 001,0.95 m% %9,5%100. 3175,6 005,0.5,74 m% %6,92%100. 3175,6 1,0.5,58 m% 2MgCl KCl NaCl == == == 5.64 Híng dÉn gi¶i : a) Cho Cl2 t¸c dông víi dung dÞch Ca(OH)2 : Cl2 + Ca(OH)2 → CaOCl2 + H2O 2Cl2 + 2Ca(OH)2 → Ca(ClO)2 + CaCl2 + 2H2O Hçn hîp A chøa : 2 2 2 CaOCl Ca(ClO) CaCl 152,4.50% n 0,60( 100%.127 152,4.28,15% n 0,30( 100%.143 152,4.(100 50 28,15)% n 0,30( 100%.127 = = = = − − = = mol) mol) mol). Sè mol Cl2 ®· tham gia ph¶n øng : 2 2 2 2Cl CaCl CaOCl Ca(ClO)n n n n= + + = 1,2 mol ThÓ tÝch khÝ Cl2 ®· tham gia ph¶n øng : V = 1,2.22,4 = 26,4 lÝt. b) Khi nung hçn hîp A : 3Ca(ClO)2 → o t 2CaCl2 + Ca(ClO3)2 6CaOCl2 → o t 5CaCl2 + Ca(ClO3)2 36
- 37. Sè mol CaCl2 trong hçn hîp B : 0,16,0. 6 5 3,0. 3 2 3,0n 2CaCl =++= (mol) Sè mol Ca(ClO3)2 trong hçn hîp B : 2,06,0. 6 1 3,0. 3 1 n 23)ClO(Ca =+= (mol) - Thµnh phÇn hçn hîp B : %83,72%100. 4,152 0,1.111 m% 2CaCl == 5.65 Híng dÉn gi¶i : - Ph¶n øng x¶y ra khi cho M t¸c dông víi Cl2 vµ dung dÞch HCl : 2M + nCl2 → 2MCln (1) 2M + 2mHCl → 2MClm + mH2 (2) - Gäi sè mol M ®· ph¶n øng lµ a, ta cã : 2 3 m n 2 ma .5,1 2 na =⇒= (I) ⇒ n = 3, m = 2 lµ phï hîp 2886,1 a)m5,35M( a)n5,35M( = + + (II) ⇒ M = 52 ; VËy M lµ Cr (crom) 5.66 Híng dÉn gi¶i : a) Gäi sè mol KCl, KBr trong hçn hîp lÇn lît lµ x vµ y. C¸c PTHH : KBr + AgNO3 → AgBr↓ + KNO3 (1) KCl + AgNO3 → AgCl↓ + KNO3 (2) Khèi lîng muèi thu ®îc : mAgNO3 = mAgCl + mAgBr = 143,5x + 188y = 170(x + y) ⇒ 18y = 26,5x %mKCl = 29,84% ; %mKBr = 70,16%. b) Sè mol KCl = 0,100mol ; sè mol KBr = 0,1474mol ; sè mol AgNO3 = 0,353mol. Ta thÊy : sè mol AgNO3 > (sè mol KCl + sè mol KBr) nªn AgNO3 d, c¸c ph¶n øng (1) vµ (2) x¶y ra hoµn toµn. Khèi lîng kÕt tña thu ®îc : mAgCl + mAgBr = 42,061g 37
- 38. Dung dÞch thu ®îc chøa : 0,1056mol AgNO3, 0,2474mol KNO3. Khèi l- îng dung dÞch : mdung dÞch = 282,939g. Nång ®é c¸c chÊt trong dung dÞch : 3AgNOC% = 6,34%, 3KNOC% = 8,83%. 5.67 Híng dÉn gi¶i : FeO + 2HCl → FeCl2 + H2O Fe + 2HCl → FeCl2 + H2 nFe = 0,015mol ⇒ mFe = 0,84g ; mFeO = 0,36g ; %mFe = 70% nHCl = 0,03 + 0,005 = 0,035(mol). ThÓ tÝch HCl cÇn dïng 350,0ml. 5.68 Híng dÉn gi¶i : 2NaCl + 2H2O 2NaOH + Cl2 + H2 (1) - Khèi lîng NaOH nguyªn chÊt : m = 400,0kg hay 10,0kmol. Theo ph- ¬ng tr×nh (1) sè mol Cl2 hay H2 thu ®îc lµ 5,0kmol. 0,1124,22.0,5VV 22 HCl === m3 . - Dïng lîng Cl2 nµy ®Ó ®iÒu chÕ níc Gia –ven : Cl2 + 2NaOH → NaCl + NaClO + H2O (2) Sè mol NaClO thu ®îc lµ 5,0kmol. Khèi lîng níc Gia – ven 5% thu ®îc lµ : 7450 %5 %100.5,74.0,5 m == kg. 5.69 C¸c ph¬ng tr×nh ho¸ häc : 1. 2NaCl 2Na + Cl2 hoÆc 2NaCl + 2H2O 2NaOH + Cl2 + H2 §Òu lµ ph¶n øng oxi ho¸ - khö. 38 §iÖn ph©n nãng ch¶y §iÖn ph©n dung dÞch cã mµng ng¨n §iÖn ph©n dung dÞch cã mµng ng¨n
- 39. 2. Cl2 + H2 → 2HCl hoÆc Cl2 + 2HI → 2HCl + I2 §Òu lµ ph¶n øng oxi ho¸ - khö. 3. 2HCl + 2K → 2KCl + H2 lµ ph¶n øng oxi ho¸ - khö hoÆc HCl + 2KOH → KCl + H2O kh«ng lµ ph¶n øng oxi ho¸ - khö 4. Nh ph¶n øng ë môc 1, thay NaCl b»ng KCl. 5. Cl2 + 2HBr → 2HCl + Br2 lµ ph¶n øng oxi ho¸ - khö 6. Br2 + Ba → BaBr2 lµ ph¶n øng oxi ho¸ - khö 7. BaBr2 + H2SO4 lo·ng → BaSO4 + 2HBr kh«ng lµ ph¶n øng oxi ho¸ - khö 8. 16HBr + 2KMnO4 → 2KBr + 2MnBr2 + 5Br2 + 8H2O lµ ph¶n øng oxi ho¸ - khö 9. Br2 + 2HI → 2HBr + I2 lµ ph¶n øng oxi ho¸ - khö. 5.70 Híng dÉn gi¶i : a) 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O (1) MnO2 + 4HCl → 2MnCl2 + Cl2 + 2H2O (2) b) Gi¶ sö lîng ho¸ chÊt cña mçi chÊt ®· lÊy lµ m gam, theo c¸c ph¬ng tr×nh ta cã : 8787 . 1 1 n 316 5 158 . 2 5 n )2(Cl)1(Cl 22 mmmm ==>== (I) VËy nÕu lÊy cïng khèi lîng KMnO4 vµ MnO2 cho t¸c dông víi dung dÞch HCl ®Æc, d th× dïng KMnO4 sÏ thu ®îc nhiÒu khÝ Cl2 h¬n. c) Khèi lîng KMnO4 lµ x gam, khèi lîng MnO2 lµ y gam. Theo (I) ta cã : 15,0 4,22 36,3x5 nnn )2(Cl)1(ClCl 222 ==+=+= 87316 y (II) 39
- 40. khèi lîng hçn hîp : m = x + y = 10,0 (III) Gi¶i hÖ ph¬ng tr×nh, thu ®îc : x = 8,1g KMnO4 chiÕm 81% khèi lîng y = 1,9g MnO2 chiÕm 19% khèi lîng. 5.71 Híng dÉn gi¶i : a) Al + XCl3 → AlCl3 + X a a a mol Theo ®Þnh luËt b¶o toµn khèi lîng : mdung dÞch ®Çu + mAl = mdung dÞch sau + mX ⇒ mdung dÞch ®Çu - mdung dÞch sau = mX - mAl = 4,06 ⇒ mX = 7,84g Xa = 7,84 vµ 27a = 3,78 ⇒ a = 0,14 mol ; X = 56 ⇒ X lµ Fe. b) Cho NaOH d t¸c dông víi dung dÞch Y, sau ®ã sôc CO2 d AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl Al(OH)3↓ + NaOH → NaAlO2 + 2H2O NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3 Khèi lîng kÕt tña : m = 78a = 10,92g. 5.72 Híng dÉn gi¶i : a) Gäi sè mol Mvµ Fe trong mçi phÇn lµ 2x vµ 3x mol. 3Fe + 2O2 → Fe3O4 (1) 4M + nO2 → 2M2On (2) Fe + 2HCl → FeCl2 + H2 (3) 2M + 2nHCl → 2MCln + nH2 (4) 2Fe + 3Cl2 → 2FeCl3 (5) 2M + nCl2 → 2MCln (6) M t¸c dông víi dung dÞch HCl v× dung dÞch thu ®îc trong suèt. Ta cã : - Khèi lîng hçn hîp oxit : m = 4,33)n16M2( 2 x2 232. 3 x3 =++ g (I) 40
- 41. - Sè mol H2 thu ®îc : 60,0 4,22 44,13 2 nx2 x3n 2H ==+= mol (II) - Sè mol Cl2 ph¶n øng : 75,0 4,22 8,16 2 nx2 2 x3.3 n 2Cl ==+= mol (III) Gi¶i hÖ ph¬ng tr×nh, thu ®îc : x = 0,1 mol, nx = 0,3 mol, Mx = 2,7g ⇒ M = 27 lµ nh«m. b) Hçn hîp gåm Al : 3 . 2x = 0,69 mol ; Fe : 3 . 3x = 0,9 mol. %mAl = 23,32% ; %mFe = 76,68%. 41
