Este documento resume la revisión de 54 especies de murciélagos del Paraguay basada en el examen de 4,674 ejemplares de museo y literatura relevante. Se documentan seis familias de murciélagos y se agregaron seis nuevas especies a la fauna del Paraguay en los últimos 10 años. Se verificó el patrón de variación geográfica de color y tamaño en murciélagos del noroeste al sureste del país.





![© BlOSFERA. Publir:aciunes del Comite Elpaíiul del Programa
MaB y de la Red lberoMaB de /a UNESCO
(Organim¡n Autónomo de Parques Narr(l!1o!es
Minis/erí, ' de Medio Ambiente).
Publicaciones del Comité EspaJ101 del Programa MaR y
Plaza de San Juan de la Cruz, s/I!. 2807J Madrid. España.
Teléfonos 91 597 68 27 - 91 5976828/341- 597.68.27 - 68.28
Fax9! 85 y3415S17.85
Comisión Nacional de Cooperación Coll la UNESCO.
Paseo Juan XXII/. 5. 28040 Madrid. b·paña.
Colaborun: Fundación '¡¡¡z,?os del Coto
Fundación Ecn.fera
Asociación Macaronesia
Asociación Na/ura Hispánica
Doíiano
Asociación Centro de EstudiOS ii'opicales
Sevilla, ,?O05
Red lbaoMaB de la UNr.'SCO.
Portada: "Murciélagos del Paraguay" del Profesor Ricardo Lflpez-Wilchis
Diseíio gráfico/maque/ación: Fernando ZambrwlO Moyano
Sevilla, '!004
I.S.S.N,; 1/38-8]53
Depósito legal: SE-628-98](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-6-320.jpg)



![Celia López-González: MurciélEf10s del Paragua"LY___
]JI
------------------------
RESUMEN
Se ha revisado el estado taxonómico y la distribución de las especies de murciélagos
(Chiroptera) del Paraguay con base en el examen de 4674 ejemplares de museo y la
bibliografía pertinente. Se documentan 54 especies de murciélagos pertenecientes a
seis familias: Emballonuridae (1), Noctilionidae (2), Phyllostomidae (20), Natalidae
(l), Vespertilionidae (13) Y Molossidae (17). Las especies Platyrrhinus dorsalis,
P helleri y Myotis levis no se aceptan para la fauna del país a pesar de haber sido
citadas previamente para el Paraguay, pero con registros dudosos o basados en
ejemplares mal identificados. Queda sin resolver el estado taxonómico de algunas
poblaciones de Artibeus y Eptesicus, así como de los Eumops de pequeño tamaño
(E. bonariensis beckeri, E. b. bonariensis, E. b. de/ticus y E. patagonicus). Se
verifica el patrón general de variación geográfica observado previamente para los
murciélagos paraguayos: los molósidos y vespertiliónidos de ambientes áridos o
semiáridos tienden a presentar colores más claros y a ser de menor tamaño que los
de ambientes más húmedos. Se comprueba que no existe un límite bien definido para
estas diferencias, sino un continuo que va del noroeste al sureste del Paraguay.
En los últimos 10 años se han agregado seis especies a la fauna de quirópteros
del Paraguay: Tonatia brasiliense, Chiroderma dorÍae, Diaemus youngi, Nata/us
stramineus, Histiofus macrofus y Molossus currentium. Con excepción de D. youngi,
todas ellas representan extensiones significativas en la distribución previamente
conocida para cada una de estas especies. Es probable que su presencia en el Paraguay
haya pasado inadvertida hasta hace poco, aunque también es posible que sean
invasores recientes. El Paraguay se localiza en un zona de transición entre varios de
los biomas más extensos de América del Sur, por lo que su fauna es una combinación
de especies de los biomas componentes, y ninguna es endémica. La actividad humana
y los cambios que ella supone pueden estar alterando la diversidad y abundancia de
los seres vivos. Determinar el efecto que los cambios antropogénicos han tenido en
las poblaciones silvestres de quirópteros es un campo todavía por ser investigado en
el Paraguay, y es una línea que adquiere gran relevancia dada la importancia de los
murciélagos como polinizadores, dispersores de semillas, controladores de plagas
de insectos, o como plagas del ganado.](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-10-320.jpg)






![7
111. MATERIAL Y MÉTODOS
3.1. Ejemp1ares examinados
Este trabajo es el resultado del examen de ejemplares de murciélagos paraguayos
depositados en museos de Norteamérica, Europa y el Museo de Historia Natural del
Paraguay. Sin embargo, y debido a limitaciones logísticas, no fue posible examinar la
mayor parte de los especímenes depositados en museos europeos y se requiere también
una considerable cantidad de trabajo adicional en las colecciones paraguayas. Se revisó
un total de 4,967 ejemplares, los cuales se listan en el apartado correspondiente a cada
especie. Se examinaron pieles y cráneos así como individuos preservados en alcohol,
con o sin el cráneo extraído. Se utilizaron también ejemplares de localidades fuera
del Paraguay con fines comparativos, los números de catálogo de dichos ejemplares
no se incluyen en el documento. El material examinado se encuentra depositado en
las colecciones que se enumeran a continuación, los acrónimos para cada una de
ellas son los que se utilizan en todo el texto: Museo Nacional de Historia Natural
del Paraguay, San Lorenzo (MNHNP); en Europa: Estación Biológica de Doñana,
Sevilla, España (EBD); Muséum d'Histoire NaturelIe, Ginebra, Suiza (MHNG); y en
los Estados Unidos: Field Museum of Natural History, Chicago (FMNH); Ml1seum of
Comparative Zoology, Harvard University, Cambridge (MCZ); Ml1scum ofVertebrate
Zoology, University of California-Berkeley, (MVZ); Museum of Texas Tech
University, Lubbock (TTU); University of Connecticult Ml1seum of Natural History,
Storrs (UCONN); Museum of Zoology, University of Michigan, Ann Arbor (UMMZ);
National Museum ofNatural History, Washington, D. C. (USNM). Los ejemplares que
se listan con el acrónimo TK no han sido todavía catalogados, por lo que el número de
referencia es el del catálogo de campo. La mitad de éstos se encuentra depositada en
el Museo de Texas Tech University, en tanto que la otra mitad forma parte del acervo
del Museo Nacional de Historia Natural del Paraguay.
Se presenta una clave dicotómica para las especies paraguayas, basada
principalmente en las de Myers y Wetzel (1983) para el Chaco Boreal y Anderson
(1997) para Bolivia, en la que se utilizan características externas y craneales, tanto
cualitativas como cuantitativas. Estas últimas son fácilmente determinadas con un
vernier o calibre, o pueden ser aproximadas con una regla.
La clave está basada en ejemplares adultos; dado que tanto las proporciones
craneales como la coloración varían con la edad del individuo, debe usarse con cautela
en relación a ejemplares juveni les o subadultos. Se utilizaron los Índices craneal (CRI)
y mandibular (MXI) de Baud y Menu (1993) tanto en la clave como en el tratado de
las especies del género Myotis. Los Índices fueron calculados como sigue:
CRI =[(lNC+BBC)GLS]/2
MXI = [(BAC+BAM)LNR]/2
donde BAC, BBC, BAM, GLS, INC, y LNR son medidas craneales que se describen
más adelante. Debido a que LNR no equivale exactamente a "CM3" en Baud y Menu
(1993), el Índice maxilar así calculado sobreestima el de estos autores, si bien sigue](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-17-320.jpg)


















![Celia López-González: Murciélagos del Paraguay
Noctilio leporinllS (Linnaeus, 1758)
[Vespertilio]leporinus Linnaeus, 1758:32
Vespertilio minor Fcrmin. 1765:30
Noctilio americanus Linnaeus. 1766:88
Pleropus leporinus Erxleben, 1777:130
Vespertilio labialis Kerr. 1792:93
Vespertilio mastivus Vahl. 1797: 132
NIoctilio] rufescens 01 fers, 1818:225
Noctilio unicolor Desmarest 1818:15
Noctilio dorsatus Desmarest 1818:15
Noctilio vi/latus Schinz, 1821:870
Noctilio leporillus Gray, 1827:67
Ce/aeno brocksianCl Leach, 1821 :70
Noctilio rufus Spix, 1823:57
Noctilio rufipes d Orbigny, 1835:pl. 9, fig 4.
29
Material tipo. Ninguno originalmente designado. La especie fue descrita por
Linnaeus (1758), quien se basó en una descripción hecha por Seba (1734). Carter y
Dolan (1978) consideraron que el ejemplar Vespertilio leporinus Linnaeus (British
Museum of Natural History 67.4.12.399), macho adulto, es el que Seba utilizó para
describir la especie, y es, por tanto, el holotipo de Noctilio leporinus. La localidad tipo
fue restringida por Thomas (1911 b) a Surinam.
Comentarios taxonómicos. Los Noctilio leporinus del Paraguay han sido incluidos
en la subespecie N. l. rufescens Olfers, 1818 (Davis, 1973). La descripción de esta
subespecie se basó en la del "chauve-souris rougeatre" de Azara (1801), localidad
tipo, el Paraguay. Myers y Wetzel (1983) examinaron una muestra de cuatro machos
y 11 hembras del Paraguay y concluyeron que sus ejemplares eran mayores que los
individuos de N. leporinus de la cuenca del Amazonas (N. l. mastivus sensu Davis,
1973), pero menores que N. l. rufescens de Bolivia y Argentina. Una muestra mucho
mayor proveniente del Paraguay produjo resultados similares (tabla 2), aunque no se
llevaron a cabo pruebas estadísticas para evaluar las diferencias formalmente. Por otra
parte, Taddei el al. (1986) describen ejemplares colectados en el sureste brasileño como
más parecidos a los de Bolivia y Argentina que a las formas amazónicas. Estos autores
sugieren la posibilidad de variación elinal en tamaño, el cual decrecería de suroeste
a noreste en Suramérica, aunque admiten que carecen de suficiente información para
documentar la tendencia adecuadamente. Como con N. albiventris, se requiere una
estudio formal de los patrones de variación geográfica de Noctilio leporinus.
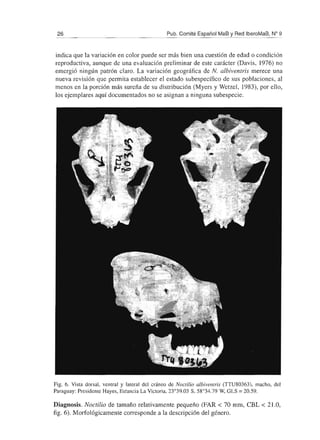
Diagnosis. La especie de tamaño mayor en el género Noctilio (FAR> 80 mm, CBL >
21 mm - fig. 8). Morfológicamente corresponde a la descripción del género.
Coloración. Como en Noctilio albiventris, aunque los ejemplares de N. leporinus
presentan la fase anaranjada más a menudo.
Especies similares. Noctilio leporinus es una especie distintiva, que puede ser
confundida sólo con la otra especie de la familia, N. albiventris. Se distingue fácilmente](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-37-320.jpg)





![36 Pub. Comité Español MaB y Red IberoMaB, N° 9
Hábitat. Esta es una especie poco común, generalmente asociada con las áreas de
bosque tropical del oriente paraguayo, incluyendo las márgenes del río Paraguay. No
obstante, se conoce un ejemplar de cerca de Cerro León, en el chaco seco y otro de
Fortín Orihuela, en el chaco húmedo (fig. 11), lo que sugiere que esta especie puede
habitar ambientes más estacionales e inestables al menos parte del año.
Alimentación. Pequeños vertebrados, insectos, fruta (Gardner, 1977a).
Estado de conservación. Potencialmente vulnerable.
Ejemplares examinados (18). Alto Paraguay: 50 Km WNW Fortín Madrejón, by
rd.., Cerro León (1, UMMZ 125416). Caaguazú: Sommerfeld, colony #11 (1, USNM
293140). Canindeyú: 6.3 Km NE Curuguaty, by rd. (1, UMMZ 124358); l3.3 Km
N Curuguaty, by rd. (1, UMMZ 125902); Reserva Natural del Bosque Mbaracayú,
24°08.06 S, 55°23.13 W, 300 m (2, TK 64036,64076). Cordillera: 1 mi S Tobatí, by rd.
(2, MVZ 144366-67). Guairá: Villarrica, Serra Pelado (l, MCZ 42231). Itapúa: Hotel
el Tirol, 19.5 Km NNE Encarnación, by rd. (1 MVZ 154705); CAISISA-Tembey, San
Raphael (sic) (1, MHNG 1695.86). Paraguarí: Cerro Santo Tomás, 3 Km E Paraguarí
(3, MVZ 144363-65); Parque Nacional Ybycuí, Casa de Administración (l, MNHNP
0042). Presidente Hayes: Fortín Orihuela (1, FMNH 54403). San Pedro: Yaguareté
Forests, Administration Complex, 23°48.50 S, 56°07.68 W, 200 m (1, TK 61193). El
Paraguay, localidad no especificada (l, USNM 105607).
Registros bibliográficos: Alto Paraná: Puerto Bertoni. Alto Paraguay: Puerto Casado;
Puerto Sastre. Central: Asunción; Colonia Elisa. Concepción: Cd. Concepción;
Colonia San Lázaro. Itapúa: Encarnación. Presidente Hayes: Chaco-i; Monte Lindo;
Puerto Cooper; Puerto Pinasco (Podtiaguin, 1944).
Género Macrophyllum Gray, 1838.
Cola prologándose mas allá del borde posterior del uropatagio; patas largas, con
pies notablemente grandes, de longitud poco menor a la de la tibia (Harrison, 1975)
y con filas de papilas sobre el uropatagio. Fórmula dental 2/2, 1/1,2/3,3/3 =34. El
género es monoespecífico, distribuido desde el sureste de México (Tabasco), Centro y
Suramérica hasta el Paraguay y norte de Argentina (Baud, 1989; Harrison, 1975; Mok
el al., 1982; Wilson y Gamarra de Fox, 1991).
Macrophyllum macrophyllum (Schinz, 1821)
Phyllost[oma] macrophyllwn Schinz, 1821: 163
Macrophyllum Nieuwiedii Gray 1838:489
Macrophyllum neuwiedii Gervais, 1856:50
Dolicophyllum macrophyllum Trouessart, 1904: 110
Macrophyllum macrophyllum Nelson, 1912:93](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-44-320.jpg)














![Celia López-González: Murciélagos del Paraguay 51
Fig. 20. Vista dorsal, ventral y lateral del cráneo de Tona/ia sylvicola (TTU35679), hembra, de
Surinam: Saramacca, Raleigh Falls, 4°44 N, 56° 12 W, GLS= 28.00.
Material tipo. No determinado. Localidad tipo "...des grandes foréts qui bordent le
pied oriental de la Cordillére bolivienne, au pais des sauvages Yuracarés" [...grandes
bosques que bordean el pie de monte oriental de la Cordillera Boliviana, en el país
de los salvajes Yuracarés]" (Medellín y Arita, 1989, p. 2), aunque anteriormente Hall
(1981) la restringió a "Yungas of Bolivia between río Securé and río Isibara."
Comentarios taxonómicos. Se reconocen cuatro subespecies de T sylvicola. Las
poblaciones paraguayas, junto con las bolivianas y las del suroeste brasileño, se
pueden asignar tentativamente a la subespecie nominal (Anderson, 1997; Cabrera,
1958). No obstante, no se ha estudiado en detalle la variación geográfica de T
sylvicola en la parte más sureña de su distribución y el estado de las poblaciones sigue
siendo incierto. La ortografía del nombre sylvicola ha sido materia de discusión en la
literatura. Davis y Carter (1978) y autores subsecuentes (e. g., Koopman, 1993) usaron](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-59-320.jpg)

















![Celia López-Gonzá/ez: MurciélE1I]Qs"-d.,.,e"'-I'-P...ar.",a"'Qu""a"-y______ 69
Distribución en el Paraguay. Esta especie se ha reportado de la Región Oriental del
Paraguay, desde Ñeembucú hasta Concepción y Amambay (fig. 29).
Hábitat. Handley (1991) y Marques-Aguiar (1994) han sugerido queA.fimbriatus se
halla asociado con áreas boscosas, y que la fuerte deforestación de las áreas intermedias
podría explicar el aparente vaCÍo en la distribución de esta especie entre el noreste y
el sureste de Brasil. La distribución de las colectas de A. fimbriatus en el Paraguay
parece apoyar esta idea. Los ejemplares examinados fueron colectados en áreas de
bosque tropical, excepto aquellos provenientes de Ñeembucú, que fueron capturados
en una huerta de bananas y naranjas emplazada en un ambiente chaqueño. Esta especie
se ha registrado también en la ciudad de Asunción, lo que sugiere más bien que la
disponibilidad de refugios y fruta, naturales o antropogénicos, es el factor limitante
para su distribución. Como las otras dos especies de Artibeus del Paraguay (Baud,
1981; Myers y Wetzel, 1983), A. fimbriatus puede encontrarse también, en algunas
épocas del año, en la región occidental, en áreas riparias a lo largo del río Paraguay.
Alimentación. Fruta, flores, hojas, insectos.
Estado de conservación. Estable.
Ejemplares examinados (114). Alto Paraná: Escuela Técnica Forestal, near Laguna
Yrendy (4, USNM 552729; MNHNP 0232, 0235, 0238); Reserva Limoy, Itaipú
Binacional (l, MNHNP 1990). Amambay: Parque Nacional Cerro Corá (3, MNHNP
1304, 1319, 1295). Canindeyú: 6.3 Km NE Curuguaty, by rd. (1, UMMZ 124366);
13.3 Km N Curuguaty, by rd. (4, UMMZ 125914, 125943-44, 146451); Estancia Itabó,
24°26.18 S, 54°39.76 W, 450 m (12, TK 64618, 64636-37, 64651-54, 64662, 64665,
64669,64701,64718); Estancia Ttabó, 24°30.19 S, 54°38.28 W, 450 m (1, TK 64737);
Estancia Rivas, 24°26.23 S, 54°39.98 W 300 m (9, TK 63501-02, 63577, 63606,
63608,63612-14); Reserva de Mbaracayú (1, MNHNP 1946); Reserva Natural del
Bosque Mbaracayú, 24°07.53 S, 55°30.66 W, 200 m (1, TK 61864); Reserva Natural
del Bosque Mbaracayú, 24°07.69 S, 55°30.34 W, 200 m (1, TK 61822); Reserva
Natural del Bosque Mbaracayú, 24°08.08 S, 55°31.68 W, 200 m (7, TK 61894,61896,
61899, 61927-30); Reserva Natural Privada Itabó, 24°26.68 S, 54°39.92 W, 450 m
(2, TK 64729-30); Reserva Natural Privada Itabó, 24°27.81 S, 54°39.85 W, 450 m
(1, TK 63410); Reserva Natural Privada Itabó, 24°27.92 S, 54°38.13 W, 450 m (5,
TK 63469, 63471, 63474, 63493-94); Tierra del Banco Mundial (1, MNHNP 1257).
Central: 4 Km ESE Asunción (1, MVZ 144444); 5 Km EAsunción (2, MVZ 144441-
42); Asunción, 1.6 km NE jct. ay. Gral. Genes and Sn. Martín (2, MVZ 144432,
144435); Asunción, Recoleta (3, MVZ 144454; UMMZ 125399-400). Concepción:
Parque Nacional Serranía San Luis, 22°37.91 S 57°21.35 W, 270 m (5, TK 61498,
61499, 61501. 61529, 61531); Parque Nacional Serranía San Luis, 22°40.34 S
57°20.96 W, 170 m (1, TK 61508); Parque Nacional Serranía San Luis, 22°40.96 S
57°21.52 W, 150 m (1, TK 61598). Cordillera: Estancia Sombrero, 25°02.67 S,
56°39.35 W, 90 m (l TK 60484); Estancia Sombrero, 25°04.20 S, 56°86.13 W, 110
m (1, TK 64761); 1.6 Km S Tobatí, by rd. (1, UMMZ 146452); 12 Km N TobalÍ, by
rd. (1, MVZ 144461). Itapúa: Colonias Unidas, Lapachal (3, MNHNP 1346, 1351.
1834*); Distrito Heriberta Stroessner, colonia Taruma, on Arroyo Taruma (l, MNHNP](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-77-320.jpg)

![Celia López-González: Murciélagos del Paraguay 71
Fig. 30. Vista dorsal, ventral y lateral del cráneo de Artibeus jamaicensis planirostris (TK61506),
hembra, del Paraguay: Departamento Concepción, Parque Nacional Serranía de San Luis, 22"40.34 S,
57"20.96 W, 170 m, GLS= 28.88.
Material tipo. Phyllostoma planirostre, lectotipo, ejemplar adulto, depositado en el
Zoologische Staatssammlung, Munich, Alemania (ZSM [65]/1903/9437, colectado
cerca de Bahia, Brasil (Handley, 1991).
Comentarios taxonómicos. Aunque la variación mOlfológica en Artibeus jamaicensis
de Suramérica es amplia, es posible distinguir siete subespecies (Handley, 1987). La
presencia en el Paraguay de una especie deA rúbeus distinta deA. lituralus fue reconocida
primero por Bertoni (1939), quien utilizó el nombre Artibeus planirostris para referirse
a ella. Su trabajo, sin embargo, no proporciona suficiente información para establecer a
cual de los taxa actualmente reconocidos se estaba refiriendo. Podtiaguin (1944) utilizó
el mismo nombre para designar ejemplares que, de acuerdo con las medidas dadas en
su trabajo, corresponderían a A. jamaicensis planirostris (sensu Handley, 1989, 1991).
Baud (1981) usó la combinación A. jamaicensis planirostris aplicada por primera vez
a la especie más pequeña de los tres Artibeus por él reconocidos: A. lituratus, A. j.
planirostris y Artibeus sp. (A . fimbriatus) . En este trabajo se sigue a Baud (1981) y](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-79-320.jpg)






















![94 Pub. Comité Español MaS y Red IberoMaS, N° 9
~--
Bosque Mbaracayú (7, MNHNP 2081-87); Reserva Natural del Bosque Mbaracayú,
24°07.04 S,55°32.67 W, 200m (1, TK61805); Reserva Natural del Bosque Mbaracayú,
24°07.53 S, 55°30.66 W, 200 m (11, TK 61777-79, 61865-72); Reserva Natural del
Bosque Mbaracayú, 24°07.61 S,55°30.84 W (2, TK 61823-24); Reserva Natural del
Bosque Mbaracayú, 24°08.04 S, 55°31.71 W, 200 m (9, TK 61782,61784-87,61798-
99, 61886-87); Reserva Natural del Bosque Mbaracayú, 24°08.08 S, 55°31.68 W,
200 m (30, TK 61800-02, 61873-78, 61881-82, 61901-19); Reserva Natural Privada
Itabó, 24°26.68 S, 54°39.92 W, 450 m (1, TK 64732); Reserva Natural Privada Itabó,
24°27.47 S, 54°39.85 W, 300 m (5, TK 63405, 63407, 63425-27); Reserva Natural
Privada Itabó, 24°27.92 S, 54°38.13 W, 300 m (12, TK 63442,63448-49,63452-54,
63461-63,63467,63470,63495); río Jejui-mí (3, MNHNP 2084-86). Central: 4 Km
ESE Asunción (6, MVZ 144400-01, 144403; UCONN 16422-24); 5 Km EAsunción (1,
MVZ 144399); near Asunción (1, FMNH 28410); Asunción, 1.6 Km NE jct. av. Gral.
Genes and av. San Martín (5, MVZ 141886, 144394-96,144398); Asunción, Recoleta
(2, UMMZ 125869; MVZ 144397); Colonia Nueva Italia, departamento Villeta (1,
FMNH 54400). Concepción: 8 Km E Concepción, by rd. (10, MVZ 144384-93);
Parque Nacional Serranía San Luis (13, MNHNP 1919,1921,1923,1931-40); Parque
Nacional Sen-anÍa San Luis, 22°34.92 S, 57°21.25 W, 270 m (11, TK 61551-61);
Parque Nacional Sen-anía San Luis, 22°37.91 S, 57°21.35 W, 270 m (23, TK 61476-
80,61486,61488,61490-94,61532-38,61573-75, 61638); Parque Nacional SenanÍa
San Luis, 22°40.34 S, 57°20.96 W, 170111 (LO, TK 61443-48, 61470-71,61608-09);
Parque Nacional Serranía San Luis, 22°40.96 S, 57°21.52 W, 150111 (2, TK 61592-93).
Cordillera: Estancia Sombrero, 25°02.67 S, 56°39.35 W, 90 m (3, TK 60483,60485-
86); Estancia Sombrero, 25°04.56 S, 56°36.08 W, 110 m (1, TK 60539); Estancia
Sombrero, 25°04.20 S, 56°36.13 W, 110 m (12, TK 64760, 64798, 64824, 64826,
64828, 64835-36,64838-42); 12 Km N Tobatí, by rd. (6, MVZ 144402-07). Guairá:
Villa Rica (6, USNM 104930, 105590-92, 115048-49). Itapúa: Colonias Unidas,
Lapachal (2, MNHNP 0848,01430); Distrito Heriberta Stroessner de Iglesia, Colonia
Tarumá (12, MNHNP 0441-43,0447-500452-55,0458); 22 Km NNE Encarnación,
by rd. (5, UMMZ 124334-38); Hotel El Tirol, 14.5 Km (sic) NNE Encarnación, by rd.
(7, MVZ 155511-17); Hotel El Tirol, 19.5 Km NNE Encarnación, by rd. (27, MVZ
152809-16,152818,154707-24); 3.5 Km E San Rafael (2, UMMZ 125864-65); 8 Km
N San Rafael (5, UMMZ 125861-63, 125866, 1258(8); Parque Nacional San Rafael,
26°45.46 S, 55°51.67 W, 170 m (7, TK 60909-10, 60919, 60939-40, 60954, 60970);
Parque Nacional San Rafael, 26°45.70 S, 55°52.32 W, 170 m (1, TK 60918); Parque
Nacional San Rafael, 26°45.87 S, 55°52.81 W, 170 m (4, TK 60900, 60906-08); 1 Km
N mouth río Paraná, río Pirapó (15, UCO]¡{-J 16916-26, 16930-33). Misiones: 2.7 Km
N San Antonio, by rd. (15, UMMZ 124339-50, 124352-53, 125215); Boca Atinguy,
Ayolas (2, EBD 12726-27). Ñeembucú: Estancia Yacaré, 26°35.41 S, 58°06.12 W,
60 m (4, TK 61696-97, 61736-37); Estancia Yacaré, 26°37.97 S, 58°07.55 W, 60
m (16, TK 61661-68, 61680-81, 61691-95, 61709); Estancia Yacaré, 26°38.94 S,
58°04.78 W, 60 m (2, TK 61657,61660); Estancia Yacaré, 26°39.58 S, 58°05.56 W,
60 m (1, TK 61656). Paraguarí: Estancia Ypoá, 25"56.36 S, 5]026.71 W, 120 m (1,
TK 60558); Lago Ypoá, 26°02.48 S, 57°25.94 W, 120 m (2, TK 60584,60586); Lago
Ypoá, 25°56.30 S, 57°26.66 W, 120 m (2, TK 60554,60578); Lago Ypoá, 25°56.36 S,
5]026.71 W, 120 m (3, TK 60555-56,60576); Lago Ypoá, 25°56.71 S, 57°26.80 W,
120 m (6, TK 60560-63, 60571, 60574); Parque Nacional Ybycuí (8, MNHNP 0115,](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-102-320.jpg)








![Celia López-Q()nzález: Murciélagos del Paraguay 103
Registros bibliográficos. Alto Paraguay: Puerto Sastre. Amambay: Pedro Juan
Caballero. Boquerón: Camacho. Caaguazú: Caaguazú. Itapúa: Colonia Hohenau;
Encarnación. San Pedro: Nueva Germania (Podtiaguin, 1944). Paraguay: Chaco
(Bertoni, 1939); Puerto Juan Barbero (Podtiaguin, 1944).
Género DiaemllS MilIer, 1906
Murciélagos con orejas relati vamente largas, pulgar corto, COIl un sólo cojinete
debajo del metacarpo; membrana interfemoral con pelos ralos, puntas de las alas
blancas. Distribuido ampliamente en América neotropical, aunque poco común en
toda su distribución. Fórmula dental l/2, 1/1, 1/2, 2/1 = 22, premolares superiores
posteriores vestigiales que a menudo se pierden (Koopman, 1988). El género es
monoespecífico.
DiaemllS yOllngi (Jentinck, 1893)
Desmodus youngi Jentinck, 1893:278
Diaemus youllgi cypselinus Thomas, 1928:285
Material tipo. Holotipo, macho adulto (RNH 12088), depositado en el Rijksmuseum
van Natuurlijke Historie, Leyden, Holanda, colectado en "upper Canje Creek, Berdice"
[tributario del río Berbice], Guyana (Carter y Dolan, 1978).
Comentarios taxonómicos. El estado de Diaemus como género distinto de Desmodus
ha sido tema de numerosas discusiones (Koopman, 1988), aunque las revisiones más
recientes confirman su posición como géneros diferentes (Greenhall y Schutt, 1996;
Koopman, 1988, 1994). No se reconocen subespecies.
Diagnosis. Pulgar antcrior corto (aproximadamente un octavo de la longitud del tercer
metacarpo), un sólo cojinete bajo el metacarpo, puntas de las alas blancas, calcar
ausente, constricción postorbital ancha, de modo tal que es casi imperceptible, proceso
coronoide alto, elevándose sobre el cóndilo (fig. 46).
Coloración. Pelaje dorsal pardo, de textura sedosa, muy semejante al de Desmodus en
color y textura; el vientre más claro, casi blanco. Membranas ligeramente más oscuras
que el pelaje dorsal, puntas de las alas blancas.
Especies similares. Desl1lodus rotundus (ver diferencias en apartado correspondiente).
Diphylla ecaudnta es similar, pero no presenta cojinetcs en los metacarpos, presenta
calcar, aunque pequeño, las patas y la membrana interfemoraI están cubiertas de pelo
y los incisivos inferiores tienen el borde aserrado.
Dimorfismo sexual. No se ha documentado.
Variación geográfica. No se ha documentado.](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-111-320.jpg)


![106 Pub. Comité Español MaB y Red IberoMaB, N° 9
Mayo, Destacamento Patricio CaImán (1, MNHNP 0823). Presidente Hayes: Estancia
La Victoria, 23°39.04 S, 58°34.79 W, 120 m (1, TTU 75273); Estancia Loma Porá,
23°29.92 S, 57°32.92 W, 77 m (3, TK 64518, 64540, 64568); Estancia Loma Porá,
23°29.93 S, 5]032.89 W,77 m (6, TTU 75278-75283).
Registros bibliográficos. Alto Paraguay: Fuerte Olimpo (Gamarra de Fox y Martin,
1996), aunque este reporte puede ser elTóneo (López-González el al., 1998).
Familia Natalidae Gray, 1866
Murciélagos con orejas en forma de embudo, segundo dedo de las extremidades
anteriores reducido al metacarpo (desaparece la primera falange). Cola larga, envuelta
por completo en el uropatagio, formada por vértebras muy alargadas (generalmente
cinco), que llegan hasta el borde posterior de la membrana. Caja craneana globular,
rostro largo. Sobre el rostro y debajo de la piel se desarrolla un engrosamiento de tejido
en forma de campana, de posible naturaleza glandular, exclusivo de los machos de
esta familia ("natalid organ" -Goodwin, 1959). Distribuidos en América neotropical,
desde el norte de México hasta Brasil central y el Paraguay, incluyendo las Antillas
(Koopman, 1994; López-González el al., 1998). La familia incluye un género y cinco
especies, tres conocidas sólo de las Antillas (Natalus micropus. N. tumidifrons y N.
lepidus). Las otras dos CN. tumidirostris y N. stramineus) se distribuyen en Sudamérica
continental, sólo ésta última se ha registrado en el Paraguay.
Género Natalus Gray, 1838
Características y distribución son las de la familia. Fórmula dental 2/3, l/1, 3/3, 3/3
=38 (Dalquest, 1950; Koopman, 1994).
Natalus stramineus Gray, 1838
NalaLus stramineus Gray, 1838:496
NataLus dominicensis Shamcl, 1928:67
Myotis espiritosantensis Ruschi, 1951 a:7
Natalus espiritosantensis Ruschi, 1970: 5
Material tipo. Según Carter y Dolan (1978), dos sintipos, colectados en Brasil y
depositados en el British Museum of Natural History, constituyen el material tipo.
Sin embargo, en un trabajo más reciente sobre el origen e identidad del material tipo
de esta especie, HandJey y Gardner (1990) concluyeron que el holotipo (y no dos
sintipos) de Natalus stramineus es BMNH 70.2324, erróneamente etiquetado "Brazil."
Este es uno de los ejemplares que Carter y Dolan (1978) declararon como sintipos en
su trabajo. No existe información más específica disponible sobre el origen de este
ejemplar que "South America." Cabrera (J 958) restringió la localidad tipo a Lagoa
Santa, Minas Gerais, Brasil; Goodwin (J 959), no obstante, rechazó esta opinión y
sugirió que Antigua, en las Antillas Menores, era una localidad más probable para el
origen del tipo de N. stramineus, opinión apoyada por HandJcy y Gardner (1990).](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-114-320.jpg)













![120 Pub. Comité Español MaB y Red IberoMaB, Na 9
---~ - - - - - - - - - - - - - -- ~ - ~ - .
Rivas, 24°26.23 S, 54°39.38 W, 300 m (1, TK 63603); Mbaracayú Wildlife reserve, 2
Km E Central Camp, Arroyo Morotí, (24°7 S, 57°55 W) (1, MNHNP 0905). Central:
4 Km ESE Asunción (5, MVZ 144835-39); 5 Km E Asunción (5, MVZ 144830-34);
Asunción, comer ofEspaña and Kubitschek streets (1, MVZ 144797); Asunción, 1.6 mi
NE jct. ave. Gral. Genes and San Martín, by rd. (1, MVZ 144804); Asunción, comer of
Kubitschek and Generalísimo Franco (6, MVZ 144798-803); Asunción, Dist. Catedral
(1,AMNH 205190); Asunción, Recoleta (47,AMNH 248348; MVZ 144805-26, UMMZ
124386-97, 124449, 125331-33, 125741-43, 133787-91); Asunción, Villa Morra (1,
MVZ 144828); Asunción (3, MNHNP 0300,0303; USNM 552734); 17 Km E Luque
(1, UMMZ 125744); San Lorenzo (2, UCONN 16938; USNM 461900). Concepción:
8 Km E Concepción, by rd. (2, MVZ 144840-41); Parque Nacional Serranía San Luis,
22°37.91 S, 57°21.35 W, 270 m (5, TK 61449,61475,61579-81). Cordillera: 20 Km N
Altos, by rd. (4, MVZ 144842-45); 1.6 Km S Tobatí, by rd.(1, UMMZ 12575]); 1 mi S
Tobatí, by rd. (1, MVZ 144847); 12 Km N Tobatí, by rd (1, MVZ 144846); Tobatí (1,
UCONN 16468); Estancia Sombrero, 25°02.19 S, 56°39.04 W, 90 m (2, TK 60489-90);
Estancia Sombrero, 25°02.67 S, 56°39.35 W, 90 m (1, TK 60472); Estancia Sombrero,
25°04.56 S, 56°36.08 W 110m (1, TK 60525); Estancia Sombrero, 25°04.20 S,
56°36.13 W (l, TK 64829). Guairá: Itapé (2, AMNH 23812; FMNH 44113); Villarrica
(1, MCZ 28280). Itapúa: Distrito Heriberta Stroessner de Iglesia, Colonia Tarumá (1,
MNHNP 083 l); 8 Km N San Rafael (3, UMMZ 125747, 125749-50). Misiones: Ayolas,
Barrio San Antonio, 27°23.42 S, 56°50.15 W, 71 m (3, TK 60842-44); Refugio Yabebyry,
Estancia Santa Ana, 27°21.99 S, 56°55.50 W, 70 m (2, TK 60821,60823). Ñeembucú:
Estancia Yacaré, 26°37.97 S, 58°07.55 W, 60 m (1, TK 61722). Paraguarí: Lago Ypoá,
26°02.48 S, 57°25.94 W, 120 m (1, TK 60589); Parque Nacional Ybycuí (1, UMMZ
133792); Sapucay (14, AMNH 23813; FMNH 044114; USNM 105603, 115104-11,
115113-14, 121439). Presidente Hayes: Chaco Experimental Station, 295 Km NW Villa
Hayes by rd. (10, MVZ 144863-72); Estancia La Victoria, 23°40.07 S, 58°35.71 W, 120
m (1, TK 60061); Estancia La Victoria, 23°40.28 S, 58°35.29 W, 120 m (4, TK 60160-
63); Estancia La Victoria, 23°41.22 S, 58°35.23 W, 120 m (6, TK 60166,60169-73);
Estancia Samaklay, 23°28.81 S, 59°48.43 W, 120 m (3, TK 62749,62785,62798); 0.75
Km N Line Camp, Juan de Zalazar (L UCONN 16471); Line Camp, Juan de Zalazar (1,
UCOIfN 16469); Pozo Colorado (1, AMNH 234452); Retiro Mandeyú, 20 Km SW Km
205 Transchaco Highway (16, MVZ 144873-88); Rincón Charrúa, 275 Km NW Villa
Hayes, by rd. (11, MVZ 144852-62); 4 Km N río Verde, Juan de Zalazar (1. UCONN
15469); río Verde, 300 Km NW Villa Hayes, by rd. (1, MVZ 144796); 24 Km WNW
Villa Hayes (1, UMMZ 133786); 213 Km NWVilla Hayes, by rd. (4. MVZ 144848-51);
230 Km NW Villa Hayes, by rd. (J, MVZ 144721).
Eptesicus cf furinalis (cráneos faltantes o ejemplares completos en alcohol---
10): Amambay: Parque Nacional Cerro Corá (1, MNHNP 0304). Boquerón: Parque
Nacional Teniente Enciso, 200 m E fortín (1, MNHNP 0309); Parque Nacional Teniente
Enciso, fortín (1, MNHNP 0307). Central: 4 Km ESE Asunción (2, MVZ 144889-90);
Ypacarai, 47 Km de Asunción (sic) (3, MNHNP 1648-50). Itapúa: Distrito Heriberta
Stroessner de Iglesia, Colonia Tarumá (2, MNHNP 0446, 1652).
Registros bibliográficos. Concepción: Arroyo Azotey, nord de Cororó; entre Estancia
Estrellas et Estancia Primavera (Baud, 1981).](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-128-320.jpg)
















![Celia López-Gonzá/ez: Murciélagos del Paraguay 137
TK 60142, 60147, 60148); Estancia La Victoria 23°41.41 S, 58°35.23 W, 120 m (4,
TK 60143-46); Estancia Samaklay, 23°28.81 S, 59°48.43 W, 120 m (8, TK 62727,
62767,62781,62783,62787-88,62809-10); 0.3 Km S of Line Camp, Juan de ZaJazar
(3, UCONN 16430-32); Retiro Mandeyú, 20 Km SW Km 205 Transchaco Highway
(5, MVZ 144985-89); Villa Hayes (1, AMNH 248356); Rincón Charrúa, 275 Km NW
Villa Hayes, by rd. (51, MVZ 144944-84, 144993-145002); 107 Km NW Villa Hayes,
by rd. (4, MVZ 144930-33); 213 Km NW Villa Hayes, by rd. (5, MVZ 144935-39);
230 Km NW Villa Hayes, by rd. (4, MVZ 144940-43); 295 Km NW Villa Hayes by rd.
(1, MVZ 144990); 300 Km NW Villa Hayes, by rd. (1, MVZ 144891).
Registros bibliográficos. Paraguay: Villa Montes (Handley, 1960, en realidad situado
en Bolivia, ver Myers y Wetzel, 1983); Boggiani (Thomas, 1901 c). Boquerón: Teniente
Ochoa (Wetzel y Lovett, 1974). Central: Colonia Nueva Italia (Handley, 1960).
Género Myotis Kaup, 1829
Vespertiliónidos con incisivos superiores bien desarrollados y sin espacios entre
ellos, 12 claramente mayor que Il, ]] con una cúspide secundaria posterior bien
definida; una diastema similar en diámetro a ambos incisivos superiores juntos separa
el 12 y el canino (Miller, 1907); incisivos inferiores formando una fila convexa y
apretada; cráneo esbelto y de construcción ligera; rostro casi tan largo como la caja
craneana. Fórmula dental 2/3, 1/1, 3/3, 3/3 = 38. Este es uno de los géneros más
diversos de murciélagos, conteniendo cuatro subgéneros y 84 especies reconocidas,
aunque la validez de algunas es discutible (Koopman, 1994). El género es cosmopolita
y sólo falta en las regiones polares. Para la región neotropical se reconocen 14 especies
(LaVal, 1973). En el Paraguay se han registrado cinco especies que se incluyen en tres
subgéneros (Koopman, 1994; pero ver Menu, 1987, para una clasificación distinta de
los subgéneros). Las características a nivel de subgénero no se discuten en este trabajo,
aunque los cOlTespondientes nombres subgenéricos se mencionan en la sección de
comentarios taxonómicos de cada especie.
El estado de las poblaciones paraguayas de Myotis se discute en LaVal (1973), Myers
y Wetzel (1983) y Baud y Menu (1993). Las discrepancias entre estos autores y una
reevaluación del estado actual de las especies de Myotis en el Paraguay se presentan en
López-González et al. (2001), y se sigue a continuación. Las características distintivas
de las especies paraguayas de Myotis se resumen en la tabla 18.
Myotis albescens (E. Geoffroy, 1806)
Vespertilio albescens E. Geoffroy, 1806:204
Vespertilio leucogaster Wied-Neuwied. 1826:271
Vespertilio arsilloe Temminck, 1840:247
Myotis albescells Thomas, 1900b:546
Myotis argentaülS Dalquest y Hall, 1947:239
Material tipo. No se designó un tipo originalmente, la especie se describió con base
en el "Chauve-souris douziéme ou chauve-souris brun-oscur" de Azara (1801). La
localidad tipo es ·'".la estancia San Solano, junto al estero de Iberá", Corrientes,](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-145-320.jpg)



![Celia López-González: Murciélagos del Pa~ 141
Estancia Yacaré, 26°37.97 S, 58°07.55 W, 60 m (2, TK 6172],61766); Tacuaral (30,
MCZ 11582-85; USNM 105562-72, 105575-85, 105649, 10566], 105662, 105664).
Paraguarí: Paraguarí (4, AMNH 23808-09, 115098-99); Yaguarón (5, AMNH 205194,
205196-99). Presidente Hayes: Estancia La Victoria, 23°39.04 S, 58°34.79 W,
120m (6, TK 60095-97, 60106, 60158, 60174); Estancia Loma Porá, 23°27.87 S,
57°36.29 W, 77 m (1, TK 62170); Estancia Samaklay, 23°28.81 S, 59°48.43 W, 120 (7,
TK 62668, 62698-99, 62768, 62782, 62786, 62808); Retiro Mandeyú, 20 Km SW Km
205 Transchaco Highway (2, MVZ 144572-73); río Sombrero, approx. Km 315 Ruta
Transchaco (5, MNHNP 1630, 1634, 1635, 1639-40); 50 Km E Km 320 Transchaco
Highway (8, MVZ 144497-504); 226 Km NW Villa Hayes, by rd. (32, MVZ 144505-
36); 230 Km NW Villa Hayes, by rd. (20, MVZ 144552-71); Rincón Charrúa, 275 Km
NW Villa Hayes, by rd. (69, MVZ 144574-605, 144607-39, 144641-43, 144723); 290
Km NW Villa Hayes, by rd. (8, MVZ 144644-51); 320 Km NW Villa Hayes, by rd.
(12, MVZ 144485-96). Paraguay: río Tebicuary (4, AMNH 21756]-64).
Myotis cf albescens (sólo pieles---10): Boquerón: Parque Nacional Teniente
Enciso, 200 m E fortín (1, MNHNP 0284). Central: Asunción (1, FMNH 18218).
Cordillera: Juan de Mena (1, MNHNP 0294). Ñeembucú: Tacuaral (2, FMNH 44111-
12). Presidente Hayes: río Negro at Transchaco (1, MNHNP 0285); Km 226 Transchaco
(1, MNHNP 0279); Km 303 Transchaco (2, MNHNP 0278, 0281); Estancia La
Golondlina (1, MNHNP 0339).
Registros bibliográficos. Alto Paraguay: General Díaz. Alto Paraná: Itakyry; Taty Yupi,
Itaipú. Caaguazú: río Yucuyry, south Yhu. Caazapá: Yegros, río Pirapó. Concepción:
río Tagatiya-guazú; Estancia Santa Sofía; Estancia Primavera. Cordillera: north
Emboscada, río Piríbebuy. Presidente Hayes: río Aguaray-guazú; río Salado, north
Pozo Colorado; Transchaco, Km 170, Estero Patiño; Transchaco, Km 293, Estancia
Apéndice; Transchaco, Monte Lindo; Transchaco, río Verde. San Pedro: San Pedro,
río Jejui-guazú (Baud y Menu, j 993).
Myotis nigricans (Schinz, 1821)
Vespertilio nigricans Schinz, 1821: 179
Vespertilio parvulus Temminck. 1837:246
Vespertilio concil7llus H. Allen, 1866:280
MYOfis nigricalls Miller. 1897:74
Myotis chiriquensis J. A. AlIen, 1904:77
Myotis punensis J. A. Allen. 1914:383
Myotis bondae 1. A. Allen, 1914:384
Myotis maripensis J. A. Allen, 1914:385
Myotis esmeraLdae 1. A. Allen, 1914:385
¡lI/yotis caucensis J. A. AlIen, 1914:386
Material tipo. El ejemplar en que se basa la descripción original fue colectado por
Maximilian Zll Wied-Neuwicd en la Fazenda do Agá, cerca del río Itiriba. Espírito
Santo, Brasil. Hasta donde se sabe el ejemplar no se halla en ningún museo europeo o
americano, por lo que LaVal (1973) lo consideró definitivamente perdido y designó un
neotipo (LACM 36877), hembra adulta, colectada 42 Km S Río de Janeiro. Brasil, 33
m, depositado en Los Angeles County Museum, Los Angeles, California.](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-149-320.jpg)







![Celia López-González: Murciélagos del Paraguay 149
61411). Caaguazú: 24 Km NNW Carayaó, Estancia San Ignacio (2, UMMZ 134272-
73). Concepción: Parque Nacional Serranía San Luis, 22°37.91 S, 57°21.35 W,270
m (1, TK 61544); Parque Nacional SelTanía San Luis, 22°40.34 S, 57°20.96 W, 170
m (2, TK 61614-15). Cordillera: Estancia Sombrero, 25°02.19 S, 56°39.04 W, 90 m
(1, TK 60488); Estancia Sombrero, 25°02.67 S, 56°39.35 W, 90 m (2, TK 60494,
60496). Itapúa: Hotel el Tirol, 19.5 Km NNE Encarnación, by rd. (l, MVZ 154725);
2 Km NNW San Rafael (1, UMMZ 126242); 8 Km N San Rafael (2, UMMZ 125736-
37); Parque Nacional San Rafael, 26°45.46 S, 55°51.67 W, 170 m (1, TK 60951).
Misiones: Puerto Turi, 27°24.49 S, 56°45.74 W (1, TK 60830). Paraguarí: Estancia
Ypoá, 26°02.48 S, 5r25.94 W (1, TK 60588); Parque Nacional Ybycuí (2, UMMZ
133775-76); Sapucay (8, MCZ 26819; USNM 115071-73, 115086, 115088, 115095,
121477). Presidente Hayes: Estancia La Victoria, 23°39.04 S, 58°34.79 W, 120 m (1,
TK 60007); Retiro Mandeyú, 20 Km SW Km 205 Transchaco Highway (2, MVZ
144671, 144676). San Pedro: Yaguareté Forests, río iguaray Guazú, 23°46.22 S,
55°59.26 W, 200 m (1, TK 61275).
Registros bibliográficos. Boquerón: Estancia Iparoma, 19 Km N Filadelfia (Myers y
Wetzel, 1983); Presidente Hayes: Juan de Zalazar, left bank of río Verde, approx. 4 Km
E Transchaco Highway bridge (Wetzel y Lovett, 1974).
Myotis ruber (E. Geoffroy, 1806)
Vespfertilio]. ruber_E. Geoffroy, 1806:204
Vespertilio cinnamomemus Wagner, 1855:755
(Nuevo nombre para Vespertilio ruber, no Pipislrellus cil1l1amOmemus Miller)
Myotis ruber Thomas, 1902b:493
Material tipo. Ninguno especificado originalmente, la especie se basa en el "chauvc
souris onziéme ou chauve souris cannelle" de Azara (1801), localidad tipo el Paraguay,
restringida a Asunción por Miller y Allen (1928). LaVal (1973) concluyó que no existe
ningún ejemplar que haya sido el descrito por Azara, por lo que designó un neotipo, un
macho adulto de Sapucay (=Sapucaí), departamento Paraguarí, Paraguay, "elevation
ca. 300 m," depositado en el United States National Museum (USNM 115097).
Comentarios taxonómicos. El estado taxonómico de esta especie se discute en López-
González el aL (2001). Esta especie se incluye en el subgénero Leuconoe. No se han
descrito subespecies (Koopman, 1994; LaVal, 1973).
Diagnosis. Myotis de tamaño comparativamente grande (PAR 39.6 mm en promedio)
para el género. Plagiopatagio insertándose en la base de los dedos de las patas, cráneo
robusto y ancho, con una cresta sagital bien desarrollada; BiCIINC ¿ 1, el PM3 se
alinea con el resto de la hilera de dientes (fig, 70, tabla 18).
Coloración. Pelaje dorsal de color canela brillante, relativamente corto pero sedoso,
monocolor o sólo ligeramente bicolor; se extiende posteriormente para cubrir la
superficie dorsal del uropatagio hasta el nivel de las rodillas. Pelaje ventral amarillento,
con bases marrón oscuro.](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-157-320.jpg)






![156 Pub. Comité Español MaB y Red IberoMaB, N° 9
------------ - - -
Ambas formas se han encontrado en simpatria en el Paraguay, por lo que en este trabajo
se sigue la nomenclatura de Barquez et al. (1999) y se reconocen ambas. Sin embargo,
algunos ejemplares de Concepción y Ñeembucú son más parecidos a E. patagonicus
en tamaño para la mayoría de los caracteres (y por lo tanto fueron incluidos en esta
especie), pero tienen antebrazos inusualmente grandes. Baud (1981) examinó algunos
de estos ejemplares y sugirió la revisión del estado subespecífico del complejo "Eumops
bonariensis" (E. bonariensis beckeri, E. b. bonariensis y E. b. deLticus). Es posible que
exista una tercera forma discernible en este complejo, ya sea a nivel subespecífico o
específico. Seis especies de cste género se han registrado en el Paraguay.
Eumops auripendulus (Shaw, 1800)
Vespertilio Auripendulus_Shaw, 1800: 137
Molossus rufus E. Geoffroy, 1805:155
MoLossus amplexi-caudatus E. Geoffroy, 1805: 156
Dysopes abrasus Temminck, 1827:232
Eptesicus auripendulus Shamel, 1945: 109
Material tipo. Originalmente no se designó un tipo, la especie fue nombrada por
primera vez por Pennant (1793), a partir de una descripción y un dibujo que se
presentan en Buffon (1789). Subsecuentemente, Shaw nombró la especie Vespertilio
auripendulus (Eger, 1977). Localidad tipo "Guiana," restringida a "French Guiana"
(Guayana Francesa) por Husson (1962).
Comentarios taxonómicos. La aplicación del nombre Eumops auripendulus a esta
especie se discute en Goodwin (1960). Eger (1977) examinó la variación fenotípica en
E. auripendulus, reconociendo dos subespecies: E. a. majar, distribuida del norte de
Bolivia, Perú, y el noroeste de Brasil, hasta el sureste de México y E. a. auripendulus
del este y sureste de Brasil, el Paraguay y el norte de Argentina.
Diagnosis. Murciélago de tamaño medio (FAR 60-66 mm, CBL 24 a 25 mm en la
muestra examinada). Labio supcrior sin surcos verticales o arrugas, orejas grandes,
anchas, redondeadas, que cuando se extienden hacia delante no alcanzan la punta
anterior del hocico. Trago pequeño, lineal y terminado en punta, con una base amplia;
dos premolares superiores, el último molar superior (M3) muy reducido; fosas
basiesfenoideas pequeñas y de profundidad moderada (Husson, 1962; Koopman,
]994---fig. 74).
Coloración. Pelaje marrón rojizo a marrón negruzco, bases de los pelos individuales
beige, pelaje ventral más pálido y membranas malTón oscuro, casi negras.
Especies similares. Eumops auripendulus puede confundirse solamente con E.
glaucinus, que es de tamaño similar. Sin embargo, E. glaucinus tiene una coloración
marrón más pálida, trago cuadrado, M3 mejor desarrollado, fosas basíesfenoideas más
anchas y grandes y arcos cigomáticos convergentes, en tanto que E. auripendulus los
tiene aproximadamente paralelos.](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-164-320.jpg)








![Celia López-González: Murciélagos del Parag~ 165
Alimentación. Insectos.
Estado de conservación. Estable.
Ejemplares examinados (9). Ñeembucú: Estancia Yacaré, 26°35.44 S, 58°06.05 W,
120 m (1, TK 64428). Presidente Hayes: Estancia Samaklay, 23°28.81 S, 59°48.43 W,
20 m (1, TK 62801); Estancia Samaklay, 23°29.47 S, 54°49.18 W (2, TK 64925,
64941); 24 Km NW Villa Hayes (2, UMMZ 146476-77); 24 Km WNW Villa Hayes
(3, UMMZ 133762-64).
Registros bibliográficos. Presidente Hayes, 2 Km SE Misión Inglesa (Harrison el al.,
1979).
Eumops glaucinus (Wagner, 1843)
Dysopes glaucinus Wagner. 1843:368
Molossus ferox Gundlach, 1861: 149
Molossus glaucilJus Dobson, 1876:714
Nyctillomus orthotis J-I. AlIen, 1889:561
Molossidesfloridallus G. M. Allen, 1932:257
Material tipo. Ejemplar juvenil, sexo no determinado, sin número de catálogo,
depositado en el Naturhistorisches Museum Wien, Viena, colectado en Cuyabá
[Cuiabá, Mato Grosso] Brasil (Carter y Dolan, 1978).
Comentarios taxonómicos. Se reconocen dos subespecies, Eumops glaucinus
floridanus, restringida a Florida (Eger, 1977; Koopman, 1994) y la subespecie nominal,
que comprende el resto de la distribución conocida.
Diagnosis. Murciélago de tamaño mediano para cl género, cráneo robusto, con crestas
sagital y lambdoidal bajas y fosas basiesfenoideas anchas y profundas (fig. 80).
Coloración. Man'ón grisáceo a marrón rojizo en el dorso, la base de los pelos blanca.
Pelaje ventral más pálido que el dorso.
Especies similares. Eumops glaucinus puede confundirse sólo con E. auripendulus,
el cual es similar en tamaño. Sin embargo, E. auripendulus es de coloración mucho
más oscura, el trago es delgado y puntiagudo, el M3 está más desarrollado, las fosas
basiesfenoideas son más pequeI1as y menos definidas y los arcos cigomáticos son casi
paralelos, en tanto que en E. glaucinus son convergentes. La mandíbula de E. glaucinus
es relativamente delicada (Freeman, 1981), en tanto que la de E. auripendulus es más
robusta. Los machos de E. glaucinus poseen una glándula guiar funcional y bien
desarrollada (Best el al., 1997).
Dimorfismo sexual. La magnitud del dimorfismo sexual ha sido cuantificada para la
subespecie nominal (Eger, 1977), siendo los machos significativamente mayores que
las hembras.](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-173-320.jpg)


![168 Pub. Comité Español MaB y Red IberoMaB, N° 9
en etiqueta, debe decir: 24°30.19 S, 54°38.28 W); Estancia Itabó, 24°30.19 S,
54°38.28 W, 450m(3, TK 64740-4 1, 64746); Estancia Rivas, 24°30.43 S, 54°38 .25 W,
300 m (4, TK 63521, 63523, 63536, 63560). Concepción: Parque Nacional Serranía
San Luis, 22°36.81 S, 57°21. 17 W, 270 m (1, TK 64168); Parque Nacional Serranía
San Luis, 22°37.91 S, 57°2] .35 W, 270 m (1, TK 64163). Presidente Hayes: Estancia
Samaklay, 23°28.81 S, 59°48.43 W, 120 m (3, TK 62724,62800,64901); Estancia
Samaklay, 23°29.47 S, 59°49.18 W, 120 m (2, TK 64924,64937); Rincón Charrúa,
275 Km NW Villa Hayes, by rd. (5, MVZ 145133-37).
Registros bibliográficos. Concepción: Arroyo Tagatiya-mi, entre Isla Real et Estancia
Santa María; entre Estancia Estrellas et Estancia Primavera (Baud, 1981).
Eumops patagonicus Thomas, 1924
Eumops palagollicus Thomas, 1924:234
Eumops bonariensis beckeri Sanborn, 1932:354
Material tipo. Holotipo, hembra adulta, depositada en el British Museum of Natural
History (BMNH 23.12.12.18), localidad tipo Chubut, Argentina (Carter y Dolan,
1978; Thomas, 1924).
Comentarios taxonómicos. Barquez et al. (1993, 1999) revalidaron el nombre
Eumops patagonicus Thomas para las poblaciones antes incluidas en E. bonariensis
beckeri. En el Paraguay los límites de estos taxa están aun poco definidos, e incluso es
posible que exista una tercera forma (ver apartado cOITespondiente a E. bonariensis).
Diagnosis. Eumops de cráneo relativamente pequeño y delicado, rostro corto, caja
craneana redondeada en su parte frontal, fosas basiesfenoideas separadas por un septo
estrecho (fig. 82); CBL generalmente menor de 19 mm. Quilla interior del la oreja no
extendiéndose más allá del borde anterior del antitrago (Barquez et al., 1993).
Coloración. En ejemplares del Paraguay oriental el pelaje dorsal varía de marrón
oscuro, casi negro, a rojo brillante, en tanto los del chaco son de color marrón grisáceo,
más claro que en la Región Oriental. Aparecen pelos blancos en mayor o menor grado
en la mayoría de los ejemplares, y en algunos casos incluso aparece un parche blanco
bien definido en la garganta. Vientre gris, con las puntas de los pelos blanquecinas,
produciendo un aspecto escarchado.
Especies similares. Esta especie puede ser confundida sólo con Eumops bonariensis,
el cual sin embargo presenta un cráneo mayor, rostro más largo, frontales menos
abombados y fosas basiesfenoideas separadas por un septo más ancho (Bárquez et
al., 1999). Externamente, E. pafagonicus es menor que E. bonariensis en longitud del
antebrazo (aunque existe solapamiento, tablas 22 y 25). Por otro lado, la quilla interior
de la oreja no se extiende más allá del borde anterior del antitrago (Barquez el al.,
1999), en tanto que en E. bonariensis la quilla interna de la oreja termina detrás del
borde posterior del mismo.](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-176-320.jpg)

























![194 __P_ub_. Comité Español MaB y Red IberoMaB, N° 9
Alimentación. Insectos.
Estado de conservación. Estable.
Ejemplares examinados (44). ARGENTINA: Corrientes: Goya (1, USNM 141530).
EL PARAGUAY: Alto Paraguay: Bahía Negra, Estancia Doña Julia, 5 Km N ciudad,
20 m río Paraguay (9, MNHNP 0384-86, 0389-93, 0397); Estancia Doña Julia,
20°10.98 S, 5Ro04.42 W, 60 m (27, TK 61004-13, 61016-18, 61020-31, 61056,
61149); Fuerte Olimpo (5, FMNH 145296, 145274, 145290; MHNHP 1956, 1960);
Laguna General DÍaz (2, MHNG 1744.82, 1744.83).
Registros bibliográficos. Ninguno.
MoloSSllS molossus (Pallas, 1766)
V[esperrilio]. Jv/olossus_Pallas, 1766:49
V[espertilio]. Mol[ossus]. major Kerr, 1792:97
V[espertilio]. Mol[ossus). minor Kerr, 1792:97
Molossus obscurus_E. Geoffroy, 1805: 155
Molossus longicaudatus_E. Geoffroy, 1805: 155
Molossusfuscivenler E. Geoffroy, 1805:155
Molossus crassicaudalus E. Geoffroy, 1805:155
Molossus acuticaudatus Desmarest, 1820:116
Dysopes velox Temminck, 1827:234
Molossus moxensis d Orbigny, 1835:pl. 11
Molossusfuliginosus Gray, 1838:501
Molossus tropidorhynchus Gray. 1839:6
Molossus pygmaeus_Miller. 1900: 162
Dysopes fwnarius_Schinz, 1844: 114
Dysopes olivaceofuscus Wagner, 1850:202
Dysopes amplexicaudatus Wagner, 1850:202
Molossus pygmaeus Miller, 1900: 162
Molossus verrilliJ. A. AlIen, 1908:581
Molossus fortis Miller, 1913a:89
Molossus debilis_Miller, 1913a:90
Molossus daulensis J. A. Allen, 1916:530
Molossus milleri 10l1nson. 1952:197
Molossops planirostris espirilosantensis Ruschi, 1951c:2
Material tipo. La historia del nombre molossus y el ejemplar que lleva dicho nombre
es compleja. El problema principal surge del hecho de que el nombre Vespertilio
molossus Pallas se basó en tres ejemplares, uno de ellos perteneciente a la especie
Nyctinomops macrotis y los otros dos al género Molossus. Para evitar confusiones,
Husson (1962) designó uno de estos Molossus como lectotipo de Vespertilio molossus.
El ejemplar, un macho adulto, se halla depositado en el Museum d Histoire Naturelle
en París (número MNHN A419/225). Este autor restringió la localidad tipo a Martinica,
Antillas Menores. La discusión en la que se fundamentan estas decisiones se reporta
en Husson (1962) y Dolan (1989).](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-202-320.jpg)















![Celia López-Gonzá/ez: Murciélagos de~/-,-P-=a~ra=g=u=a1Y_______ 211
Género Tadarida Rafinesque, 1814
Murciélagos con orejas considerablemente largas que no se unen en su parte
media, labios con numerosas arrugas. Longitud de la segunda falange del cuarto dedo
más de la mitad que la de la primera. Cráneo con una emarginación palatal anterior
bien desarrollada, rostro estrecho y cresta sagital baja. Fóm1Ula dental 112-3; 1/1; 212;
3/3 = 30-32. El género se distribuye en los trópicos y subtrópicos de todo el mundo.
Una especie, Tadarida brasiliensis, se distribuye en el continente Americano (Wilkins,
1989; Koopman, 1994).
Tadarida brasiliensis (1. Geoffroy, 1824)
Nvctinomlls brasiliensis 1. Geoffroy, 1824:343
Dysopes llaslItus Temminek. 1827:234
Nyclinomus mllrinus Gray, 1827:66
Nyct(icea) cynocephala LeConte, 1831 :432
Molossllsflllginosus Cooper, 1837:67
Dysopes naso Wagner, 1840:475
Rhil1opoma carolinensis Gundlach (no Geoffroy), 1840:475_
Molossus mexicanlls Saussure, 1860:283
Nyctinomus musclIlus Gundlaeh, 1861: 149
Nyctinomus mohavensis Merriam, 1889:25
Nyctinomlls anlillarum Miller, 1902:398
N)'ctinomlls bahamensis Rehn, 1902:641
Mormopterus peruanus J. A. AlIen, 1914:311
Tadarida intermedia Shamel, 1931:7
Tadarida constanzoe Shame1, 1931: 10
Tadarida texana Stager, 1942:49
R.[hizomops] brasiliensis Legendre, 1984:421
Material tipo. Serie tipo depositada en el Museum d Histoire Naturelle, París (números
MNHN 800, 801, 802, 803---Rode, 1941; Carter y Dolan, 1978). Según estos autores
y Shamel (1931), Geoffroy no designó ninguno de estos ejemplares como holotipo,
por lo que constituirían sintipos. Rode (1941), sin embargo, llama al ejemplar MNHN
800 el holotipo y a los restantes tres, paratipos, sin más explicación. Localidad tipo
"Curityba, Paraná. Brazil" (=Curitiha, Paraná, Brasil---Shamel, 1931).
Comentarios taxonómicos. Sereconocen nueve subespecies (Koopman, 1994), aunque
Owen el al. (1990) consideran que Tadarida brasiliensis cynocephala podría constituir
una especie aparte. Las poblaciones del Paraguay pueden adscribirse a la subespecie
nominal. Con base en el análisis de caracteres dentales de Tadarida provenientes
de toda su distribución, Legendre (1984) concluyó que las poblaciones del Nuevo
Mundo deberían incluirse en un género aparte: Rhiz'omops, nombre aplicable a todas
las poblaciones de T brasiliensis. Owen el al. (1990), sin embargo, consideraron que
la separación de Rhizomops esta hecha con base en caracteres plesiomórficos, por lo
que no hay sostén filogenético para la separación. Sin embargo, admiten la posibilidad
de que eventualmente se encuentren sinapomorfías que ayuden a resolver la relación](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-219-320.jpg)
![212 Pub. Comité Español MaB y Red IberoMaB, N° 9
- - - - - - - - - _ . .
de Rhizomops con el resto de los Tadarida_(grupo Tadarida sensu Legendre, ]984), Y
señalan que el nombre Rhizomops pennanece disponible para T brasiliensis.
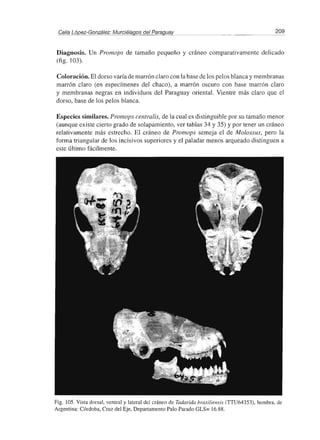
Diagnosis. Descripción general la del género (fig. 105). Una especie relativamente
pequeña (FAR < 45 mm), las orejas no se extienden más allá de la punta de la nariz
cuando se doblan hacia delante. Trago romo y corto, antitrago ancho en la base y
aproximadamente triangular.
60
Bolivia
20
'------
Brasil
N
+
Argentina
____1O,...!'iiI-~_"'Ii_Iiil.-IIIIOIiiiiiiii-iiiiiiilIOIIIIOIlllllll1lllllll2"'!OO Kilomet_crs_ _ _ _ _ _ 1
Fig. 106. Distribución de Tadarida brasiliensi. en el Paraguay.
Coloración. Uniformemente parda en el dorso y ligeramente más pálida en el vientre,
los pelos pueden tener las puntas blancas, dando apariencia escarchada al pelaje.
Especies similares. Puede confundirse solamente con los miembros del género
Nyctinomops. Sin embargo, a diferencia de ellos, Tadarida brasiliensis no tiene las
orejas unidas por la línea media, la segunda falange del dedo IV mide más de la mitad](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-220-320.jpg)






![Tabla 1. Medidas externas y craneales de NOClilio u/hi'·(·/I(/,{. de tres regiolles de Paraguay por sexo. Para cada carácter se proporciona tamaño de la muestra,
media, desviación estándar, mínimo y máximo. Las abreviaturas se (bll ell Malcrial y Métodos.
GLS
á
C~~~",.".C..·.:..E:~~~'M;•.~r .~.......-:...~.....",,-IV!~~.~~IDe ti Min - Ma~ N.:._.~::.....:.. ~...~....,;....
3 19.7..:t::0.13: 19.6-19.8 13 18.5-20.1 ! 10 19.7±0.41 18.8-20.2
'--"['-"''''-'-'--'-'''"'4 ".~-_.-._~-_. -.-+"-"...." - "-..-,,.~...........'-'--'-- - ...- ..-..+---.''.-''---.-....''.~-~..,,...-.."....--
13 I 19.9..:t::0.60 '18.7-20.8 6 20.7±0.77 19.7-21.6 8 21.4±0.86 20.1-22.6
••••••- . ' . . . - . _ . - '""'''''''oO''''''''-'oO''-''-'-'''- ••••-+oO- ."... _oO........ ! ...- ..".-.................. I
18.5 ±0.66 17.7 - 19.0.._..._....." ..." ............_.".;---_._...._•....._."...
18.2 - 9.4
13.1-15.5....._..........~ .._...•... ~.
13.0-16.7-_.....__.¡-_._-
15.4-15.5
--"'-'--
15.6..:t::0.27 15.2-16.1
]8:?±9.:.?~.._.:.~7..~=J2.:?"L_1_0__-+_._19... 1 J:. 0.28 18.6 - 19.4
19.6 ± 0.38 19.2 - 20.1 8 20.2 ± 0.38 19.7 - 20.8~._._..; .................
]4.3 ± 0.36 8 14.8 ± 0.30 14.2 - 15.2,---_....,................
]5.7 ±1.43 14.2 - 17.7
15.1±0.33
15.7 ± 1.43
14.6 - 15.7 14.7-16.0
---_..+--
15.9 - 16.9
IN~ 3 5.8 -+ 0.2'-7'-'--"- ....._--,--...
6.1 ±0.12 6.9 - 6.2
5.9 - 6.7
6.4 - 6.9
6.9 - 7.7
- --_.+--_._-=-- _._._.,--
á I J3 I 5.9 -= 0.20
3 6.6..:t:: 0.34
7.0~0.21 6.7-7.3., ..... ........_._-+_ ..__ ..
9.6 ~ 0.24...._ .........L ...........
9.3-9.8
9.8..:t:: 0.24 9.4-10.3.......- ....... -.. ...-. ---1 ..
7.4..:t:: 0.26 7.1 - 7.6
-:--_......
7.3 - 8.07.6..:t:: 0.21_ : _ -
7.0 - 7.9
9.6 ±0.26 9.4 - 10.3
10.1 ± 0.29 9.9 - 10.7
7.6 ± 0.23 7.2 - 8.0
7.3 ±0.35 7.0 - 7.9
6.2 ± 0.23
6.7 ± 0.17
7.4 ± 0.23
9.9 ± 0.24
10.2 ± 0.16
±O.IO
9.5-10.4
9.9- 10.4
7.4-8.0
7.9 - 8.2
I~](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-227-320.jpg)


















![Tabla 17. Medidas externas y craneales de Lasiurus ega de Paraguay, por sexo. Para cada carácter se proporciona tamaño de la muestra, media, desviación
estándar, mínimo y máximo. Las abreviaturas se dan en Material y Métodos.
N
GLS 16.1 - J7.1
I--··-··"""·~_··'··-··"·"--¡---·-----~ --~._--¡ -~--~-_._- . _ - -
CBL
MAB
ZYG
33
16.J ±0.28
9.1 ±0.2
11.5 ± 0.22
4.6 ± 0.15
6.2 ± 0.17
7.4±0.18
5.6±0.16
6.4 ± 0.20
15.5 - 16.6
8.6 - 9.5
10.8·11.8
7.0·7.7
5.3 - 5.9
6.0 - 6.8
117.0 - 139.0
X,,EJ]) .
~•• : ....~.:••••_ ., •••::;;:.~.',-,-•• ú , ••••
16.1.:::: 0.37
_ .. -------------<-..__._....._-----~_ ...
15.5±0.34
8.8 ± 0.21
10.9 ± 0.32
6 ± 0.16
7.2 ± 0.25
5.4 ± 0.17
6.1 ± 0.19
119.7±4.80
14.8 - 16.2
_·__ ······,,··1
8.4 - 9.3
10.2· 11.8
5.6 - 6.4
6.7 - 7.9
5.1 - 6.0
5.8 - 6.5
107.0 - 127.0126.1:!:: 5.93
56.5 ± 3.72
~---t---_._.'--
MCIII 15
9.1±0.91
16.5 ± 1.63
¡3.8±3.31
48.0± 1.24
55.1±I.71
48.0 - 63.0
7.0 - 11.0
13.0-21.0
10.0 - 30.0
45.4 - 49.8
51.8 - 57.8 22
53.5::':. 4.28 45.0 - 61.0
9.5 ± 2.13 6.0 - 11.0
............... - .•._--_.. -.....
17.5±5.55 13.0.21.0
11.5 ± 1.30 9.0 - 14.0
46.2 ± 1.44 44.3 - 49.7
452.8 ± 214 49.8 - 57.9
11'0
I~
lJ
e
O"
oO
3
$":
m
Ul
"O
III
:::J'
Q.
5:
III
IJJ
'<
:o
ro
o.
I~o
5:
III
IJJ](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-246-320.jpg)

![Tabla 19. Medidas externas y craneales de Myoris albescens de Paraguay, por sexo. Para cada carácter se proporciona tamaiio de la muestra, media, desviación
estándar, mínimo y máximo. Las abreviaturas se dan en Material y Métodos.
HF
EAR
WT
FAR
MCllI
4.0 ~ 0.11
3.5:,::0.10
5.4±0.12
5.8=0.13
4.9±0.12
_._...,..........................................
5.2.±.0.14
---+- .._._....._..._.. .- .. --
85.8:,:: 3.74
6.1 ~ 0.88
34.0 ± 1.06
32.1 ± 1.11
7.0 - 7.6
7.9 - 8.9
6.7 - 7.5
4.8 - 5.4
75.0 .. 98.0
26.0·39.0
4.0 . 9.0
31.8 - 36.8
30.1 ·34.8
5
5
5
x ± ID
14.2±0.25
'.:': 'r":"':'
...._ ....._ ..._ .._ .....__......_._._--,..................... __..•••, .•- ..........._._•.__.._<
13.2 ± 0.25
7.4±0.12
8.5 ± 0.10
7.2±0.11
4.1 ±0.12
3.5 ± 0.07
5.4±0.10
5.9 ± 0.05
4.9 ± 0.05
5.2 ± 0.07
86.6 ± 3.29
31.2 ± 4.49
8.2 ± 0.84
11.8 ± 1.64
6.7 ± 0.25
34.3 ± 0.78
32.1 ± 1.12
13.0 - 13.6
7.2 -
8.4 -
7.1 -
4.0 -
3.4 -
5.3 -
5.8 -
I~
IlJ
e
o-
O
I~m·
m(f)
Il5:
¡n
OJ
]J
m
o..
o-
m
(3
5:
¡n
OJ](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-248-320.jpg)






![Tabla 25 COIl.
O€CiU:tDNTAL of, ,. 0WENTAL
w __~w."'_;'._.• }~}o18~~'i~=fi~~.'~__J,....._~"'_·:....J~....._··__·_.._··*~·-_7..;_~;·d~_±'·_....,_··~O..~_:"'·_l·~··_··..";·_L:_..~-_..~+._.~==.=;.~__"~..9_.."~....~.....i.:""
7.0 ± 0.16 _ ......._6"'...7.._-_7.._.4._.__.._......1 .........."'..., ................__...7......3_;:;;;.,±_0_...2....5......____ ............._....__7.......0.._-._7.._8.._ ..._____ ~
.MAN· 12.6±0.35 12.3 -13.1
13.1 ± 0.40 12.5 - 13.5
··__·_..·..._·~_....._-·..·"'-----------~I
TL 98.3 ± 2.12 95.0 - 101.0
102.5 ±6.57 13 101.7 + 3.68 96.0 - 110.0....._ ....L ...._ ......................=-___..._._ ~....____._.._._~..__._..;
35.5 + 3.65 28.0 - 50.0 8 30.0 - 34.0
35.7:!: 4.08 27.0 - 53.0 13 33.0 - 42.0
HF 9.4 ± 0.85 8.0 - 11.0 8 9.6:±. 1.06 8.0 - 11.0_................ c._ ...__¿~.......____~ - .....4.._..~~~.~._....~.~. '...~-~.._..~~..~--._--_.__...--~
/É~
ó 4.0 - 12.0 9.8 ± 0.80 .........._+.__..._8..°..._-._1_1.0._...._ .._ 1
13.0 - 21.0 18.3 ± 1.16 16.0 - 20.0........ _......__........."........_-_.._-;:;;;;-_._.._..... ;-----..__..._......_._--:....._-_.~--_.."'. ...... .................-.
14.0 - 21.0 18.8 ± 1.83 14.0 - 21.0
WT 9.0-16.0 12.9-16.4
ó 146 12.7:±.1.70 8.7-16.6 11.9-]6.2
'? 42.2 - 45.9 42.0 - 44.8 _._..._j43.8::t:: 1.02
ó
?
41.3 - 45.0'._..• _., A'.. "N.. '_."'~'''~''''A''._ _ '' _ _~A_i
45.2 ± 1.83 42.8 - 47.0.........+.._.._.. ~.._....._...._ ....=--___"~~dr".___. -_._."--,,iMán
44.0::t:: 1.37 40.0 - 47.0......_-_..."..__..wt"_.._··,....·...._..·,,-_· -~---
45.4 ±1.29 43.1 - 48..6,.............__._-<.._-_._....~....
ó 45.7 ± 1.26"..__~~":,,~~_...j.,_~~.,,.~,...;; ~ _ ..._.._ ..._"...... •".........""..,..·_w..._~ .._..".......~,_ .._ ..~ ,~"......
45.9 ± ].21 42.3 .. 48.6 44.0 - 46.9
I~](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-255-320.jpg)


![Tabla 28. Medidas externas y craneales de Molossops planirostris de Paraguay, por sexo. Para cada carácter se proporciona tamaño de la muestra, media. desviación
estándar, mínimo y máximo. Las abreviaturas se dan en Material y Métodos.
15.9
15.2 ± 0.62 14.2 - 15.9 16.5 .±. 0.49 15.9 - 17.1
.................. ............._.•._...
10.0 .±. 0,27 9.6-10.4 10.8::::::. 0.24 10.5 - 11.1
10.5 ~ 0.27 10.0 - 10.7 11.3 ± 0.36 10.9 - 11.6
-_._---,_. _.""n..............~.""'''_
4.1 ± 0.16 3.9 - 4.4 4.3 ±. 4.2 - 4.4
4.2±0.10 4.0 - 4.3 4.9 :!. 0.14 4.8 - 5.1
7.2 ± 0.11 7.6 .±. 0.22 7.5 - 7.9
,_·.,...."""'·r""'"w_"'''...-'/··•.,.''''''·· ""m""'''' ,,_..,.~
MAX 7 5.8 :::: 0.19 6.5::::::. 0.23 6.3 - 6.8
..........._.._----_..__._- - , - .. o" ............._ ••~ ..... _ ••••
MTR 7 6.3 ± 0.26 7.0 ± 0.33 6.6 - 7.3
- ._------- -,- .._._.._.....__....~ ....
TL 88.9 ± 8.17 87.0.:!::0.81 86.0 - 88.0
....... "»~""'".~".,,..
TAlL ¡ 26.6::::: 2.76 23,0 - 30.0 25.8 .±. 0.96 25.0 - 27.0
.,v,·v,'~.,·""""'~,,~,.· .,.- o'
HF 8.4 .±. 0.98 7.0 - 10.0 8.0 ::::::. 1.41 7.0 - 10.0
EAR 14.3 :!. 1.11 13.0 - 16.0 15.0::::::. 0.00
-'~~""'","
WT 7 9.3 =1.0 I 8.0 - 10.8 11.1 -1- 1.87 9.0-12.5--
.~'~''''' ....''v~'''-A~'T . _ - - - - -
FAR 7 31.2 ± 1.02 29.9 - 33.1 4 32.4 , 0.24 32.1 - 32.6-
----- -----
MCnr 7 32.6 ± 1.21 30.4 - 34.0 4 35.1 ~
1.35 34.0 - 37.0
._~"''''''"''~< .• "" .. o• • • l .......... .__...._..._..- ..........~ .._-""~."".~ ..~".~ ..,.......
-u
e
~
O
O
3
@:
]J
ro
o.
cr
ro
(3
~
m
_OJ
;;¡¡
c.o](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-258-320.jpg)

![Tabla 29. Con.
OCCI))~~TAIL 'ORmNTAL
'X'~jD':
.• .v.m"'M'
]'Iin - M~~
12
11 5.7±0.15
7 76.7 ± 3.45
12 71.3 ± 12.9466.0 - 87.0._...._ _ _• .J._ _.
16.0 - 30.0 26.7 ± 4.35"""","-'"m__"",,~ .•·.~, .,....,~,~~ ",,·,·"w···.., _ .
27.1±2.11
5.0 - 9.0 7.0 ± 0.87
5.0·9.0 6.5 ± 1.00
12 ± 1.34 7.0 - 15.0 11.8 ± 0.67
~._" ..-..~.-
12.1 ± 1.63 9.0·21.0 12.6 ± 1.01
5.0.±. 0.66 4.0·6.6 5.9 ± 0.55'~_"J"'''''''·''~ _ _ _ _'''H~'·'''"''··
4.1·7.0 6.5 ± 0.93
.MC111
á
w w' . .:..w.•~.", ".~ .,',..
Min-.M'ax
5.2 - 5.7
5.4 - 5.9
74.0 - 83.0
48.0 - 85.0
22.0 - 37.0
23.0 - 30.0
6.0 - 8.0
5.0 - 8.0
.-------_.
11.0 - 13.0
11.0 - 14.0
5.3 - 6.6
5.4·7.5
I~
I~cr
I~(]l.
m
1-2
I!
I~](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-260-320.jpg)










![266 Pub. Comité Español MaB y Red IberoMaB, N° 9
- - - - -
Gardner, A. L. (1977b). Chromosomal variatíon in Vampyressa and a review of
chromosomal evolution in the Phyllostomidae (Chiroptera). Systematic
Zoology 26:300-318.
Gardner, A. L., Y D. C. Carter. (1972). A new stenodermine bat (Phyllostomatidae)
from Pem. Occasional Papers, The Museum, Texas Tech University 2: 1-4.
Gardner, A. L., YC. S. Ferrell. (1990). Comments on the nomenclatoria1status of some
Neotropical bats (Marnmalia: Chiroptera). Proceedings of the Biological
Society of Washington 103:501-508.
Genoways, H. H., YS. L. Williams. (1984). Results ofthe Aleoa FOllndation-Suriname
Expeditions. IX. Bats of the genus Tonatía (Marnmalía: Chiroptera) in
SlIriname. Annals ofthe Carnegie Museum 53:327-343.
Geoffroy Saint-Hilaire, E. (1805). Mémoire sur quelqlles challve-souris d'Amerique
formant une petite famille sous le nom de MoLossus. Annales du Muséum
National d'Histoire Naturelle, París 15:157-198. (N)
Geoffroy Saint-Hilaire, E. (1806). Mémoire sur le genre et les espéces de Vespertilion,
1'un des genres de la familie des Chauve-souris. Annales du Muséum National
d 'Histoire Naturelle, París 8: 187-205. (N)
Geoffroy Saint-Hilaire, E. (1810). Sur les Phyllostomes et les Mégadermes, deux
genres de la famille des Chauve-souris. Annales du Muséum National
d'Histoire Naturelle, París 15:157-198. (N)
Geoffroy Saint-Hilaire, E. (1818). Sur de nouvelles chauve-souris, sous de nom de
Glossophages. Mémoires du Muséum d'Histoire Naturelle, París 4:411-418,
pis. 17-18. (N)
Geoffroy Saint-Hilaire, 1. (1824). Sur les Vespertílions du Brési1. Annales des Sciences
Naturelles 3:440-447. (N)
Gervais, P. (1847). Historia fisica y política de Chile. Zoología 1:40 Yp1.2 Y2a. (N)
Gervais, P. (1855[1856]). Marnmiféres, en Animaux nouveaux ou rares recuei/lis
pendant I 'expédition dans les parties centrales de 1'Amerique du Sud, de río
de Janeiro a Lima, el de Lima au Para, exéclltée par ordre du gouvernement
Franr;ais pendant les années 1843 a 1847 sous la direction du Comte Francis
de Castelnau. P. Bertrand, París 116 pp. -[- 20 pis. (N)
Goodwin, G. G. (1942). A summary of rccognizable species of Tonatia,_with
descriptions oftwo new specíes. Journal ofMammalogy 23:204-209.
Goodwin, G. G. (1953). Catalogue of type specimens of recent mammals in the
American Museum of Natural History. Bulletin ofIhe American Museum o[
Natural HistO/y102:207-412.
Goodwin, G. G. (I959). Bats of the subgenus Nata/us. American MlIseum Novitates
1977:1-22.
Goodwin, G. G. (1960). Thc status of Vespértilio auripendulus_Shaw, 1800, and
Molossus ater Geoffroy, 1805. American Museum Novitates 1994: 1-6.
Goodwin, G. G. (1963). American bats of the genus Vampyressa, with description of a
new species. American Museum Novitates 2125:1-24.
Gorham, J. R. (1973). The Paraguayan Chaco and its rainfall: 39-60. En Gorham, J. R
(ed.) Paraguay: ecological essays. Academy ofthe Arts and Sciences ofthe
Americas, Miami, 296 pp.
Gosse, P. H. (1851). A naturalist ssojourn in Jamaica. Longman, Brown, Green, and](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-271-320.jpg)
![Celia López-González: Murciélagos del Paraguay 267
Longmans, London, 508 pp. + 7 pIs. (N)
Gray, 1. E. (1827). Synopsis of the species of the class Mammalia: 1-296. En The
animal kingdom arranged in conformity witIJ its organization, by the Baran
Cuviec with additional descriptians ofall the species hitherto named, and
ofmany not befare notieed. by Edward Griffith, ...and others. G. B. Whittaker,
London 5: 1-392. (N)
Gray, J. E. (1838). Arevision ofthe genera ofbats (Vespertilionidae), and the description
of new genera and species. Magazine ofZoology and Botany 2:483-504. (N)
Gray, 1. E. (1839). Description of some mammalia discovered in Cuba by W. S.
MacLeay, Esq., with some account on their habits, extracted fTOm Mr.
MacLeay's notes. Annals ofNatural History or Magazine of'/,oology, Botany,
and Geology 4: 1-7. (N)
Gray, 1. E. (1842). Descriptions of sorne new genera and fifty unrecorded species of
Mammalia. Annals and Magazine ofNatural History, series 1 10:255-265.
Gray, J. E. (1844). Mammalia: 7-36, pis. 1-18. En Hinds, R. 8. (ed.). The Zoology ofthe
Voyageofthe H. M S. SulphurunderthecommandofCaptainSirEdwardBeleher...
during the years 1836-1842 Smith, Elder, and Co., London, 1:1-36 + 18 pIs.
Gray, 1. E. (1848). Obscrvations on sorne Brazilian bats, with the description of a new
genus. Proceedings ofthe Zoological Society ofLondon 1848:57-58.
Grccnhall, A. M., Y W. A. Schutt, Jr. (1996). Diaemus youngi. Mammalian Species
533:1-7.
Gr~~nhal1. A. M., G. Joermann, U. Schmidt, y M. R. Siedel. (1983). lJesmodus
i'OTlIlldu5. lvfammalian Species 202: 1-6.
,J.::-.é.lach. J. (1840) [sin título]. Monatsberichte del' Koniglichen Preussiche Akademie
des Wissenschaften zu Berlin 1840:149. (N)
.~ ..::-.dlach, 1. (1861). [sin títuloj. Monatsberichte der Koniglichen Preussiche Akademie
des Wissenschaften zu Berlin 1861: 149-156. (N)
:-Iahn, W. L. (1907). A review ofthe bats ofthe genus Hemiderma. Proceedings ofthe
United States National Museum 32: 103-118.
Hall, E. R. (1981). The mammals ofNorth America, Second ed. John Wiley & Sons,
New York, 1: 1-600 + 90, 2:601-1181 + 90.
Hall, E. R., YJ. K. Jones, JI'. (1961). North American yellow bats "Dasypterus," and
a list of the named kinds of the genus Lasiurus Gray. University ofKansas
Publications, Museum ofNatural History 14:73-98.
Handley, C. O., JI'. (1960). Descriptions of new bats from Panama. Proceedings ofthe
United States National Museum 112: 459-479.
Handley, C. O., Jr. (1965). Descriptions of new bats (Chiroderma and Artibeus) from
Mexico. Anales del Instituto de Biología, Universidad Nacional Autónoma
de México 36:297-301.
Handley, C. O., Jr. (1976). MalTunaIs of the Smithsonian Venezuelan Project. Science
Bulletin, Brigham Young University, Biological Series 20: 1-89.
Handley, C. O., JI'. (1987). New species of mammaIs from northem South Amel;ca:
fruít eating bats, genus Artibeus Leach: 163-172. En Patterson B. D. YTimm,
R. M. (eds.) Studies in Neotropical mammalogy, studies in honor of PhiJip
I-Icrshkowitz. Fie/diana, Zoology, New Series 39: 1-506.
Handlcy, C. O., Jr. (1989[1990]). The Artibeus of Gray, 1838: 443-468. En Redford,](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-272-320.jpg)







![Celia López-González: Murciélagos del'-P-"-ar:..o:3""Q-"-ua.,.,v'--____ 275
Paraguay. Revista de la Sociedad Científica del Paraguay 6:25-62.
Poeppig, E. F. (1835). Reise in Chile, Peru und aus dem Amazonenstrome wahrand
der jahre 1827-/833. F. Fleischer, Leipzig, 1:451. (N)
Power, D. M. Y1. M. Tamsitt. (1973). Valiation in Phyllostomus discolor (Chiroptera:
Phyllostomatidae). Canadian Joumal ofZoology 51 :461-468.
Proenya, M. C. (1943). "Myotis guaycurú" n. sp., morcego proveniente de Salobra,
estado de Mato Grosso (Microchiroptera, Vespertilionidae). Revista Brasileira
de Biologia 3:313-315.
Pusinieri Scala, C. A. (1987). Museos y colecciones del Paraguay. Ministerio de
Educación y Culto, Asunción, Paraguay, 56 pp.
Redford, K. H., Y1. F. Eisenberg. (J 992). Mammals oflhe Neotropics: The Southern
Cone. Volume 2, Chile, Argentina, Uruguay, Paraguay. University ofChicago
Press, 430 pp.
Rehn, J. A. G. (1902). A new bat of the genus Glossophaga. Proceedings of the
Academy o.fNatural Sciences ofPhiladelphia 54:37-38.
Rengger, J. R. (1830). Naturgeschichte der saeugethiere von Paraguay.
Schweighauserschen Buchhandlung, Basel, Switzerland, 394 pp.
Rode, P. (1941). Catalogue des types de Manuniféres du Muséum National d' Histoire
Naturelle ordre des Chiropteres. Bulletin du Muséum National d 'Histoire
Nu/urelle, París, series 2 13:227-252.
Rusehi, A. (1951a). Morccgos do Estado do EspÍtito Santo Famjlia Vespertilionidae,
chave analítica para os generos e espécies representadas no E. Santo.
Descriyao de Myotis nigricans nigricans e Myotis espiritosantensis n. sp.
e algumas observac;oes a seu respeito. Bolelim do Museu de Biología Pro!
Mello Leitao, série Zoologia 4: 1-13.
Ruschi, A. (¡951b). Morcegos do Estado do Espírito Santo. Familia Emballonuridae,
chave analítica para os generos, espccies e sub-espécics representadas no
Estado do Espírito Santo. Descriyao de Pteropteryx macrotis macrotis e
Pteropteryx kappleri. Boletim do Museu de Biología Pro! Mel/o-Leitao,
série Zoología 8: 1-13.
Ruschi, A. (1951 c). Morcegos do Estado do Espírito Santo. Chave analítica para
os generas e espécies representadas no E. E. Santo. Familia Molossidae.
Descriyao de Molossus rufus rufus, Molossops planirostris espiritosantensis
n. sub. sp., e Tadarida espiritosantensis n. sp. e dados biológicos a respeito.
Boletim do Museu de Biología Prof Mello-Leitao, série Zoologia 6: 1-19.
(N)
Ruschi, A. (1970). Moreegos do estado do Espírito Santo, Chaves analíticas e
artificiaes para a determinacao das familias, generas, espécies e subspecies
dos 1l10rcegos representados no E. E. Santo, com a descric;ao de uma nova
espécie da Familia Natalidae Mil1er 1899 da regiao do lÍo ltaunas, em
Conceic;ao da Barra e río Mucuri ao Su] da Bahia: Natalus espiritosantensis
n. sp. Boletim do Museu de Biología Pro! Mello-Leitao, série Zoolugia 43: 1-
11 + figuras sin numerar. (N)
Sanborn, C. C. (1932). The bats ofthe genus Eumops. Joumal ofMammalogy 13:347-
357.
Sanborn, C. C. (1937). American bats of the subfamily Emballonuridae, Zoological](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-280-320.jpg)



![Celia López-González: Murciélagos del Paraguay 279
Tschudi,1. J. von. (1844-1846). Theriologie. Unterschungen iiber die Fauna Peruana.
Scheitlin and Zol1ikofer, St. Gallen, 262 pp. + 17 pIs. [Lief.I-2, pp. 1-76, pis.
i-xii, 1844; Lief. 3-5, pp. 77-244, pIs. xiii-xviii, 1845]. (N)
United States Board on Geographic Names. (1957). Gazetteer No. 35, Paraguay.
Office ofGeography, Department ofthe Interior, Washington, D. c., 32 pp.
Universidad Nacional de Asunción. (1991). Vegetación y uso de la tierra de la región
occidental del Paraguay (Chaco), años 1986-1987. Facultad de Ingeniería
Agronómica, Carrera de Ingeniería Forestal-Misión Forestal Alemana (GTZ).
San Lorenzo, Paraguay, 22 pp. + mapa.
Universidad Nacional de Asunción. (1994). Uso de la tierra y deforestación en la
región oriental del Paraguay, período 1984-1991, volumen!. Facultad de
Ingeniería Agronómica, Carrera de Ingeniería Forestal-Cooperación Técnica
de la República Federal Alemana. San Lorenzo, Paraguay, 32 pp. + mapa.
Vahl, M. (1797). Beskrivelse paa tre nye Alter Flagennuse. Skrivt. Naturhist.-Selskavet
Kjobenhavl1 4: 121-138. (N)
·an Den Bussche, R. A. (1992). Restriction-site variation and molecular systematics
ofthe New World leaf-nosed bats. Journal ofMammalogy 73 :29-42.
·an Den Bussche, R. A., Y R. 1. Baker. (1993). Molecular phylogenetics of the New
World bat genus Phyllostomus based on cytochrome B DNA sequence
variation. Journal ofMammalogy 74:793-802.
'.:-o:ra. C. (1942). Ensaio Monografico sobre os Quiropteros do Brasil. Arquivos de
Zoologia do Estado de Síio Paulo 3:219-471.
~-R .. B. (1955). Cynomops malagai sp. nov. y género nuevo para la fauna ele
murciélagos de México. Acta Zoológica Mexicana 1: 1-6.
::no. L. D., y V. A. Taddei. (1976). Notas sobre Molossops temminckii temmincki(e
Mo!ossops p!anirostris_(Chiroptera-Molossidae). Naturalia 2:47-59.
.:.·Jgner, 1. A. (1840). Die Saugethiere in Abbildlll1gen nach der Natur Supp!ementband.
1. Abt. Die Affen und Fledethiere. ErIangen, München, 558 pp. (N)
agner, J. A. (1842). Diagnosen neuer Arten brasiliseher Saugethiere. Archiv
jí"irNatllrgeschichte, YViegmC/1111, Berlín 8:356-362. (N)
"agner, 1. A. (1843). Diagnosen neuer Arten Brasiliseher, Hand flugler, Archiv
fiirNatllrgeschiclzte JViegmann, Ber/in 9:365-368. (N)
·agner, 1. A. (1847). Beitrage mr Kenntnis der Saügethiere Amerika's. Konig
Bayerischen Akademie Wissenschaften 5: 119-208. (N)
agner, J. A. (liS50). Beitrage zur Kenntniss der Saügethicrc Amcrika's. K6nig
Rayerischcn Akademie Wisscnschaftcn 5:202. (N)
Wagner, J. A. (1855). DieAffen, Zahnliicker, Seutelthiere, lJufthiere, fnsekten(resser und
Handjluge¡; SupplementbandtoSchreber 'sDieSaugethiere,5: 1-81 0+55pls.(N)
Ward, H. L. (1891). Descriptions ofthree new speeies ofMexican bats. TheAmerican
Naturalist 25:743-753.
Waterhouse, G. R. (1839). The zoology ofthe voyage ofthe H. M. S. Beagle, Part 2,
Mammalia. Smith Elder and Co., London. (N)
Webster, W. D. (1993). Systematics and evolution ofthe genus Glossophaga. Special
Publications, The Museum, Texas Tech University 36: 1-184.
Webster,W. D.,yR. D.Owen. (1984).Pygodennabi labiatum.MammalianSpecies220: 1-3.
Wetzel, R. M., Y J. W. Lovett. (1974). A collection of mammals de the Chaco of](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-284-320.jpg)
![280 Pub. Comité Español MaS y Red IberoMaS, N° 9
- - - - - - - - - - - -
Paraguay. Occasional Papers, Universitv ofConnecticut, Biological Science
Series, 2:203-216.
Wied-Neuwied, Maximilian Prince zu. (1820-1821). Reise nach Brasilien in den
Jahren 1815-1817. Bronner, Frankfurt, xxiv + 2 unnumbered + 380 + 5
unnumbered pp. + 11 pIs. Band l. [Band 2, 1821, 345 pp.] (N)
Wied-Neuwied, Maximilian Prince zu. (1826). Beitrage zur Naturgeschichtevon
Brasilien. Verseichniss der Amphibien, Saugethiere und Vogel, welche auf
einer Reise Zwischen dem l3ten und dem 23sten Grade sudlicher Breite
im ostlichen Brasilien beobachtet wurden. 11. Abtheilung. Mammalia.
Saugethiere. Weimar, 2:1-620 '5 pis. (N)
Wilkins, K. T. (1989). Tadarida brasiliensis. Mammalian Species 331 :1-1 O.
Williams, D. F. (1978). Taxonomic and karyologic comments on small brown bats,
gcnus Eptesicus from South America. Almals of the Carnegie Museum
47:361-383.
Williams, D. F., y J. S. Findley. (1979). Sexual size dimorphism in vespertilionid bats.
The American Midland Naturalist 102: 113-126.
WiJliams, S. L., y H. H. Genoways. (1980). Results ofthe Aleoa Foundation-Suriname
expeditions. IV. A new species of bat of the genus Molossops (Mammalia:
Molossidae). Annals ofCarnegie Museum 49:487-498.
Williams, S. L., M. R. Willig, y F. A. Reid. (1995). Rcview of the Tonatia bidens
complex (Mammalia: Chiroptera), with descriptions of two new subspecies.
Journal ofMammalogy 76:612-626.
Willig, M. R. (1983). Composition, microgeographic variation, and sexual dimorphism
in Caatingas and Cerrado bat communities from northeast Brazi1. Bulletin of
the Carnegie Museum ofNatural History 23: 1-131.
Willig, M. R., y R. R. Hollander. (1987). Vampyrops lineatus. Mammalian Species
275:1-4.
WiJlig, M. R., y R. R. Hollander. (1995). Secondary sexual dimorphismand phylogenetic
constraints in bats: a multivariatc approach. Journal ofMammalogy 76:981-
992.
Willig, M. R., R. D. Owen y R. L. Colbert. (1986). Assessment of morphometric
variation in natural populations: the inadequacy of the univariate approach.
Systematic Zoology 35: 195-203.
Willig, M. R., S. J. Presley, R. D. Owen y C. LÓpez-González. (2000). Composition and
structure of bat assemblages in Paraguay: a subtropical-temperate interface.
Journal ofMammalogy 81 :386-40 1.
Wilson, D. E. (1991). Mammals ofthe Tres Marias Islands. 214-250, en Griffiths, T.
A. y Klingener, D. (eds.) Contributions to manunalogy in honor of Karl F.
Koopman. Bulletin o(¡he American Museum ofNatural History 206: 1-432.
Wilson, D. E. (1997). Bats in question. The Smithsonian answer book. Smithsonian
1nstitution Press, Washington D. C.
Wilson, D. E., e r. Gamarra de Fox. (1991). El murciélago Macrophyllum macrophyllum
(Chiroptera: Phyllostomidae) en Paraguay. Boletín del Museo Nacional de
Historia Natural del Paraguay 10:33-35.
Wilson, D. E., Y R. K. LaVal. (1974). Myotis nigricans. Mammalian Species 39: 1-3.
Wilson, D. E., Y 1. A. Salazar. (1989[1990]). Los murciélagos de la reserva de la](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-285-320.jpg)







![Celia López-Gonzá/ez: Murciélagos del Paraguay 289
Cantera 54, 2 km E San Lázaro, by rd. (MNI-lNP). Referida a San Lázaro. 22.17, 57.92
(USBGN)
Cantero Italo, San Lázaro (MNI-lNP) 1 km NE San Lázaro? Referida a San Lázaro 22.17, 57.92
(USBGN)
Colonia San Lázaro (Podtiaguin, 1944). San Lázaro. 22.17, 57.92 (USBGN)
8 km E Concepción, by rd. (MVZ) 23.42, 57.33 (SGM)
Concepción (Podtiaguin, 1944) Ciudad de Concepción 23.42, 57.58 (USBGJ',")
20 km S Estancia Estrellas (MI-lNG) 22.33,57.70 (SGM)
25 km S Estancia Estrella (Baud y Menu, 1993). 25 km S Estancia Estrellas. 22.33, 57.70
(SGM)
Entre Estancia Estrellas et Estancia Primavera (Baud, 1981) 22.33, 57.70 (SG:vI)
Estancia Cerrito, 23°15.14'S, 57°29.5TW (TK6) 23.25,57.49 (GPS)
Estancia Cerrito, 23°15.54'S, 57"30.21 'W (TK6) 23.25, 57.49 (GPS)
Estancia Cerrito, 23°15.64'S, 57"30.32'W (TK6) 23.25, 57.49 (GPS)
Estancia Estrellas (MHNG) 22.17, 57.70 (USBGN)
Estancia Estrellas, bord du río Apa (MI-lNG) 22.17, 57.70(USBGN)
Estancia Primavera (MI-lNG; Baud y Menu, 1993) 22.42, 57.67 (USBGN)
Estancia San Luis (Baud y Menu, 1993; TTU) 22.67, 57.35 (USBGN)
Estancia Santa Clara, 23°13.35'S, 57°31.61 °W (TK6) 23.22, 57.53 (GPS)
Estancia Santa Clara, 23°13.00'S, 57°31.33°W (TK6) 23.22, 57.52 (GPS)
Estancia Santa Sofía (Baud y Menu, 1993) 22.33,57.08 (GPS)
Horqueta (MNHNP) 23.40, 56.88 (USBGN)
Parque Nacional Serranía San Luis (MNHNP) 22.67, 57.35 (GPS)
Parque Nacional Serranía San Luis, 50 m E Administración (MNHNP) 22.67,57.35 (GPS)
Parque Nacional Serranía San Luis, Arroyo Tagatiya (MNHNP) 22.67,57.35 (GPS)
Parque Nacional Serranía San Luis, sobre Arroyo Tagatiya-mí (MNHNP) 22.67, 57.35 (GPS)
Parque Nacional Serranía San Luis, 22°34.92'S, 57"21.25'W, 270 m (TK13) 22.58, 57.35
(GPS)
Parque Nacional Serranía San Luis, 22°37.91 'S, 57°21.35'W, 270 m (TKI3) 22.58, 57.35
(GPS)
Parque Nacional Serranía San Luis, 22°40.34'S, 57"20.96'W, 170 m (TK 13) 22.67, 57.35
(GPS)
Parque Nacional Serranía San Luis, 22°40.96'S, 57°21.52'W, 150 m (TK 13) 22.68, 57.36
(GPS)
Parque Nacional Serranía San Luis, 22°36.81 'S, 57°21.ITW, 270 m (TK 13) 22.61, 57.35
(GPS)
Rio Aquidabán, río Paraguay (Baud y Menu, 1993) 23.10,57.58 (SGM)
Rio Tagatiya-Guazú (Baud y Menu, 1993) 22.75, 57.42 (SGM)
Rio Trementina, Laguna Ncgra (Baud y Mcnu, 1993) 23.12, 57.03 (SGM)
Rio Ypanc, cnv. Bclén (MHNG) 23.47, 57.3] (GPS)
2 km E San Lázaro, Cantcra 54 (UMMZ). Referida a San Lázaro. 22.17, 57.92 (CSBGN)
2 km E San Lázaro, by rd. (UMMZ). Referida a San Lázaro. 22.17,57.92 (USBGN)
1 km NE San Lázaro, by rd. (UMMZ). Referida a San Lázaro. 22.17, 57.92 (USBGN)
1 km NE San Lázaro, Cantero Halo (Myers el al., 1983). Referida a San Lázaro. 22.17, 57.92
(USBGN)
San Lázaro (MNI-lNP; USNM; Myers el al., 1983) 22.17, 57.92 (USBGN)
Tagatiya-mí (MHNG). Arroyo Tagatiya-mí. 22.67, 57.35 (GPS)
Tagatiya-mi, 30 km E Puerto Max (MI-lNG) 22.67, 57.35 (GPS)
CORDILLERA
20 km N Altos, by rd. (MVZ) 25.15, 57.35 (SGM)
Caacupé (Podtiaguin, 1944) 25.38, 57.15 (USBGN)](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-293-320.jpg)
![290 Pub. Comité Español MaB y Red IberoMaB, N° 9
- - - - - - - - - - - - - - - -
Estancia Sombrero, 25°02.19'S, 56°39.04'W, 90 m (TK4) 25.04, 56.65 (GPS)
Estancia Sombrero, 25°02.52'S, 56°39.58'W, 90 m (TK4) 25.04, 56.66 (GPS)
Estancia Sombrero, 25°02.67'S, 56°39.35'W, 90 m (TK4) 25.04, 56.66 (GPS)
Estancia Sombrero, 25°04.20'S, 56°36. J3'W, 110m (TK4) 25.07, 56.60 (GPS)
Estancia Sombrero, 25°04.26'S, 56°36.08'W, 110 m (TK4) 25.07, 56.60 (GPS)
Estancia Sombrero, 25°04.56'S, 56°36.08'W, 110m (TK4) 25.08,56.60 (GPS)
Estancia Sombrero, 25°04.20'S, 56°36.13 'W, 110m (TK4) 25.09, 56.60 (GPS)
Juan de Mena (iviNHNP; UMMZ; USNM; Mycrs y Wetzel, 1983) 24.92, 56.70 (SGM)
Juan de Mena, 1.5 km N Centro (MNHNP) 24.92, 56.70 (SGM)
North Emboscada, río Piribebuy (Baud y Menu, 1993) 25.12, 57.23 (SGM)
Saltos del Piraretá, 10 km S Piribebuy (MVZ) 25.42, 57.00 (SGM)
Salto Piraretá (MHNG) 25.42, 57.00 (SGM)
Saltos del Piraretá (UMMZ) 25.42, 57.00 (SGM)
1.5 km downstream Saltos del Piribebuy (MNH0JP). Saltos del Piraretá') 25.42, 57.00 (SGM)
Saltos del Piribebuy (MNHNP). Saltos del Piraretá? 25.42, 57.00 (SGM)
I mi S Tobatí, by rd. (MVZ, UMMZ) 25.25, 57.07 (SGM)
1.6 km S Tobatí, by rd. (MVZ, UMMZ) 25.25, 57.07 (SGM)
2 km S Tobatí, by rd. (MVZ) 25.07, 57.07 (SGM)
12 km N Tobatí, by rd. (MVZ) 25.07, 57.07 (SGM)
Tobatí (UCONN) 25.25, 57.07 (USBGN)
GUAIRÁ
ltapé (FMNH; USNM» 25.85, 56.63 (USBGN)
Numi, Arroyo Yaca-mí (Baud y Menll, 1993). Ñumi. 25.88, 56.38 (USBGN)
Tacuaral (Myers y Wetzel, 1983) Tacuarás, Ñeembucú? 26.82,57.92 (SG~)
Villa Rica (MCZ; TTU; USNM; Handley, 1990, Podtiaguin, 1944; Thomas, 190Ia). Villarrica.
25.75,56.43 (USBGN)
Villa Rica, Caroveny (AMNH) 25.67, 56.43 (SGM)
Villa Rica, Colonia Independencia (MCZ). Independencia. 25.67, 56.43 (SGM)
Villa Rica, Serra PeJado (sic) (MCZ). Referida a Villarrica 25.67, 56.43 (SGM)
Villarrica (Podtiaguin, 1944) 25.67, 56.43 (SGM)
ITAPÚA
Arroyo Pirapó, 50 m SE de la casa (MNHNP). Caseta Servicio Forestal Nacional 26.92, 55.50
(SGM)
Arroyo Pirayú-i,40 km N-NO Capitán Mesa (sic) (MHNG). 40 km NNW Cap. Meza 26.58,
55.37 (SGM)
Arroyo Poromoco, 10 km S Santa María (MHNG) 27.00, 55.90 (SGM)
Boca Atinguy, Ayolas (EBD) 27.33, 56.67 (SGM)
CAISISA-Tembey, San Raphael (sic) (MHNG) 26.67,54.92 (SGM)
Colonia Hohenau (Podtiaguin, 1944). Hohenall 27.08, 55.75 (SGM)
Colonia Lapachal (MNHNP) 27.08,55.70 (SGM)
Colonias Unidas, Lapachal (MNHNP) 27.08,55.70 (SGM)
Distrito Heriberta Stroessner, Colonia Tarllmá on AlToyo Tarumá (MNHNP)
no encontrada
Distrito Heriberta Stroessner de Iglesia, Colonia Tarumá (MNHNP)
no encontrada
Distrito Heriberta Stroessner de Iglesia, 7 km NW Caronay (MNHNP)
no encontrada
Hotel El Tirol, 14.5 km NNE Encamación, by rd. (MVZ; Podtiaguin, 1944) 19.5 km ]¡'NE
Encamación, by rd.27. ¡ 7,55.75 (SGM)
3 km SE Encamación (MNHNP)
27.33,55.90 (SGM)](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-294-320.jpg)

![292- - -
Pub. c:;omité Español MaB y Red IberoMaB, N° 9
- - - - - - - - - - - -
(GPS)
Boca Atinguy, Ayolas (EBD)
27.34,56.68
(GPS)
Estancia Santa Ana, 2r21.99'S, 56°55.50'W, 70 m (TK8)
2737,56.93
(GPS)
Estancia Santa Ana, Refugio Yabcbyry, 27°14.78'S, 56°57.62'W, 70 m (TK8)
27.25,56.96
(GPS)
Estancia Santa Ana, Refugio Yabebyry, 27°22.11 'S, 56°55.68'W, 70 m (TK8)
27.37,56.93
(GPS)
Puerto Turi, 27°24.49'S, 56°45.79'W, 70 m (TK8).
27.41,56.76
(GPS)
Refugio Yabcbyry, Estancia Santa Ana, 2]o2l.99'S, 56°55.50'W, 70 m (TK8)
27.37,56.93
(GPS)
Rescrva, Isla Yacyreta, Puerto Turi, 27°24.49'S, 56°45.79'W, 70 m (TK8).
27.41,56.76
(GPS)
Rio Atinguy 27°20.67'S, 56°40.52'W, 77 m (TK8)
27.34,56.6il
(GPS)
2.7 km N San Antonio, by rd. (UMMZ)
27.42,56.97
(SGM)
San Juan Bautista (Podtiaguin, 1944)
26.63,57.17
(SGM)
40 km S San Ignacio (AMNH, Myers y Wetzel, 1983)
27.00,57.03
(SGM)
San Ignacio (AMNH)
26.03,57.03
(USBGN)
ÑEEMBUCÚ
Estancia San Antonio, 8 km N Tacuará (MNHNP). Como Tacuarás en mapas.
26.75,57.92
(SGM)
Estancia Yacaré, 26°35.41 'S, 58°06.12'W, 60 m (TK (4)
26.59,58.10
(GPS)
Estancia Yacaré, 26°35.44'S, 58°06.05'W, 60 m (TK 14)
26.59,58.10
(GPS)
Estancia Yacaré, 26°37.36'S, 58°07.04'W, 60 m (TK 14)
26.62,58.12
(GPS)
Estancia Yacaré, 26°37.97'S, 58°07.55'W, 60 m (TK 14)
26.63,58.13](https://image.slidesharecdn.com/murcilagosdeparaguay-150123140332-conversion-gate02/85/Murcielagos-de-paraguay-296-320.jpg)











