Labovoorbereiding - gefractioneerde kristallisatie van kaliumnitraat
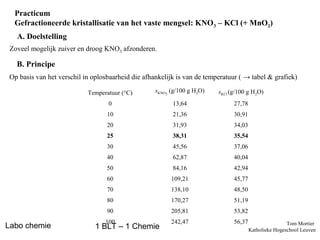
- 1. Practicum Gefractioneerde kristallisatie van het vaste mengsel: KNO 3 – KCl (+ MnO2) A. Doelstelling Zoveel mogelijk zuiver en droog KNO3 afzonderen. B. Principe Op basis van het verschil in oplosbaarheid die afhankelijk is van de temperatuur ( → tabel & grafiek) Temperatuur (°C) sKCl (g/100 g H2O) 0 13,64 27,78 10 21,36 30,91 20 31,93 34,03 25 38,31 35,54 30 45,56 37,06 40 62,87 40,04 50 84,16 42,94 60 109,21 45,77 70 138,10 48,50 80 170,27 51,19 90 Labo chemie sKNO3 (g/100 g H2O) 205,81 53,82 100 242,47 56,37 1 BLT – 1 Chemie Tom Mortier Katholieke Hogeschool Leuven
- 2. Oplosbaarheid i.f.v temperatuur (°C) sKNO 250 3 Oplosbaarheid (g/100 g water) 200 150 100 sKCl 50 0 0 10 20 30 40 50 60 70 80 90 100 Temperatuur (°C) Opdracht! Uitwerken met behulp van Excel of millimeterpapier en deze komt links in het laboschrift! Labo chemie 1 BLT – 1 Chemie Tom Mortier Katholieke Hogeschool Leuven
- 3. Oplosbaarheid i.f.v temperatuur (°C) sKNO 250 3 Oplosbaarheid (g/100 g water). 200 Gebied 4: oververzadigd aan KNO3, oververzadigd aan KCl 150 100 Gebied 2: onverzadigd aan KNO3, oververzadigd aan KCl sKCl 50 Gebied 1: onverzadigd aan KNO3 en KCl 0 0 10 20 30 Gebied 3: oververzadigd aan KNO3, onverzadigd aan KCl Labo chemie 40 50 60 70 80 90 100 Temperatuur (°C) 1 BLT – 1 Chemie Tom Mortier Katholieke Hogeschool Leuven
- 4. C. Werkwijze Verhouding Mengsel 50 g KNO3 (wit) 2, 75 g KCl (wit) 0,25 g onoplosbaar MnO2 Grijs 1) Eerste fase Onoplosbaar MnO2 verwijderen door het mengsel (bijvoorbeeld in een maatbeker van 400 ml) op te lossen en de oplossing warm (niet onder 50°C) te filtreren. De Büchnertrechter moet voorverwarmd worden. Deze procedure verschillende malen uitvoeren tot een heldere oplossing verkregen wordt (eventueel Stop niet in het water! Anders gele kristallen Alles voorverwarmen! 600 ml AD Telkens de recipiënten zuiver maken! Kraan van de pomp nooit sluiten als de zuigfles aangesloten is. Eerst de zuigfles los! Labo chemie 1 BLT – 1 Chemie Tom Mortier Katholieke Hogeschool Leuven
- 5. Oplosbaarheid i.f.v temperatuur (°C) sKNO 250 3 Oplosbaarheid (g/100 g water) 200 Bij 50°C kan 84,2 g KNO3/100 g H2O oplossen ⇒ slechts 47,17 g KNO3! 150 100 Bij 50°C kan 42,9 g KCl/100 g H2O oplossen ⇒ slechts 2,6 g KNO3! 50 sKCl 0 0 10 20 30 40 50 50 60 70 80 90 100 Temperatuur (°C) Fase 1: oplossing warm filtreren! Boven 50°C! Labo chemie 1 BLT – 1 Chemie Tom Mortier Katholieke Hogeschool Leuven
- 6. C. Werkwijze 2) Tweede fase – KCl weg! a) A-kristallen Filtraat afkoelen tot § 15°C: A1 A1 1° Zo droog mogelijk afzuigen! Minstens drie maal wassen met koud AD (ijswater). Eerst de kristallen losmaken en na het wassen droogdrukken met een klein bekertje. Controleren op Cl– Mespunt + H2OD + Ag+ Labo chemie 1 BLT – 1 Chemie Tom Mortier Katholieke Hogeschool Leuven
- 7. A1 1° Oplosbaarheid i.f.v temperatuur (°C) sKNO 3 50 sKCl Oplosbaarheid (g/100 g water) 40 15°C: X = 32,5 g KCl / 100 g H2O X 30 x 15°C: x = 25,83 g KNO3 / 100 g H2O 20 10 0 0 10 15 20 30 40 50 Temperatuur (°C) Fase 2: 15°C! KCl is volledig in oplossing, maar KNO3 niet, we zijn namelijk gestart met 47,17 g! We kunnen theoretisch 21,34 g KNO3 affiltreren! Labo chemie 1 BLT – 1 Chemie Tom Mortier Katholieke Hogeschool Leuven
- 8. C. Werkwijze 2) Tweede fase – KCl weg! A2 2° Filtraat + waswaters indampen tot § 35 ml A2 (§ 15°C) Werkwijze 1° herhalen. Controleren op Cl– Mespunt + H2OD + Ag+ Labo chemie 1 BLT – 1 Chemie Tom Mortier Katholieke Hogeschool Leuven
- 9. A2 2° Oplosbaarheid i.f.v temperatuur (°C) sKNO 3 50 40 Oplosbaarheid (g/100 g water) sKCl 15°C: X = 32,5 g KCl / 100 g H2O = 11,38 g KCl / 35 g H2 O X 30 x 15°C: x = 25,83 g KNO3 / 100 g H2O = 9,04 g KNO3 / 35 g H2O 20 10 0 0 10 15 Filtraat & waswaters indampen tot 35 ml! 20 30 40 50 Temperatuur (°C) Theoretisch is KCl nog steeds volledig in oplossing en kunnen we opnieuw een hoeveelheid KNO 3 (16,79 g) affiltreren! Met ijswater wassen omdat het KNO3 anders opnieuw oplost! Labo chemie 1 BLT – 1 Chemie Tom Mortier Katholieke Hogeschool Leuven
- 10. C. Werkwijze 2) Tweede fase – KCl weg! A3 3° Filtraat + waswaters indampen tot § 12 ml A3 (0°C) Laatste filtraat weg: veel Cl– Controleren op Cl– Mespunt + H2OD + Ag+ Labo chemie 1 BLT – 1 Chemie Tom Mortier Katholieke Hogeschool Leuven
- 11. A3 3° Oplosbaarheid i.f.v temperatuur (°C) sKNO 3 50 sKCl Oplosbaarheid (g/100 g water) 40 Y 30 20 y 0°C: Y = 27,78 g KCl / 100 g H2O = 3,33 g KCl / 12 g H2O 10 0°C: y = 13,64 g KNO3 / 100 g H2O = 1,64 g KNO3 / 12 g H2O 0 0 0 10 20 30 40 50 Filtraat & waswaters indampen tot 12 ml! Temperatuur (°C) Theoretisch is KCl nog steeds volledig in oplossing en kunnen we een laatste hoeveelheid KNO3 (7,40 g) affiltreren! Niet verder indampen dan 12 ml omdat anders KCl begint uit te kristalliseren!!! Labo chemie 1 BLT – 1 Chemie Tom Mortier Katholieke Hogeschool Leuven
- 12. b) B-kristallen Indien de A-kristallen nog Cl– bevatten B1 B2 4° 20 ml H2Odest + A3 en/of A2 en/of A1 tot verzadiging (onder kookpunt): Afkoelen tot 0°C. B1 5° Filtraat van B1 + A-kristallen. Afkoelen tot 0°C. B2 Mespunt + H2OD + Ag+ B… 6° Deze bewerking herhalen totdat alle A-kristallen omgezet zijn tot B-kristallen. c) B-kristallen testen op aanwezigheid van Cl– Labo chemie 1 BLT – 1 Chemie Tom Mortier Katholieke Hogeschool Leuven
- 13. D. Resultaat Alle kristallen A1, A2, A3, B1, B2 … samen afgeven in één pakje met naam, reeks & mKNO3. Zo droog mogelijk afgeven! Schrijf eveneens het RENDEMENT! Theoretische Berekening Eerste fase – warm 50°C: 84,16 g KNO3/100 g H2O > 50,0 g KNO3 ALLES OPGELOST! Tweede fase 15°C 15°C 0°C A1 = 47,17 g – 25,83 g KNO3 / 100 g H2O = 21,34 g KNO3 + = A1 A2 = 25,83 g – 9,04 g KNO3 / 35 g H2O = 16,79 g KNO3 + = A2 A3 = 9,04 g – 1,64 g KNO3 / 12 g H2O = 7,40 g KNO3 + = A3 Theoretisch: A = 45,53 g KNO3 Praktisch: §40 g KNO3 (vochtig) Labo chemie 1 BLT – 1 Chemie Tom Mortier Katholieke Hogeschool Leuven
