цахим үзүүлэн1
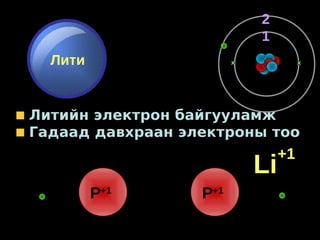
- 1. 2 1 Лити Литийн электрон байгууламж Гадаад давхраан электроны тоо +1 Li P+1 P+1
- 2. Катион + нэмэх цэнэгтэй ионыг катион - Анион Хасах цэнэгтэй ионыг анион
- 3. Li F 2 2 1 1
- 4. Электрон байгууламж Li F 2 2 1 1
- 5. Лити ба фтор Li +1 F -1 2 2 1 1 Анион ба катионыг ялгаж электрон байгууламжийг тайлбарла
- 6. катион H + устөрөгч Na+ натри Mg +2 магни Ca+2 кальци Ag +1 мөнгө
- 7. Катоин Fe+2 төмөр II валент Fe +3 төмөр (III) валент Cu+1 зэсийн (I) валент Cu+2 зэсийн (II) валент NH4+ аммони
- 8. Анион F -1 фторид Cl -1 хлорид Br -1 бромид I-1 иодид Галоген
- 9. Анион OH гидроксид -1 NO2-1 нитрит NO3 нитрат -1 PO4-3 фосфат SiO4-2 силикат SO4-2 сульфат MoO4-3 моливденит B4O7-2 борат
- 10. Давс
- 11. Фосфорын хэрэглээ • Хамгийн анхны фосфор агуулсан шүдэнз 1827 онд бүтээгдсэн бөгөөд шүдэнзний толгойг цагаан фосфороор хийдэг байжээ.Ийм шүдэнзийг ямарч гадаргууд үрэхэд асах учир галын аюултайгаас гадна цагаан фосфор хортой учир амь насанд аюултай байсан.Иймд цагаан фосфорыг аюулгүй болгон улаан фосфорыг хэрэглэх болжээ.
- 12. Хүхэрийн хэрэглээ Органик будагтай урвалд орж тэдгээрийг өнгөгүй болгодог учир бөс бараа,ноосийг цайлгахад хэрэглэнэ. • Нян болон элдэв бактери хөнөөх чадалтай учир идэшний ногоо хадгалдаг зоорь,малын хашаа саравчийг хүхэрлэг хийгээр утаж ариутгадаг
- 13. Хүхэрийн хэрэглээ ● Усан үзэмийн хортонг устгахад ● Каучукийг вулканжуулж резин гаргахад ● Эмнэлэгт арьсны өвчин , малын хамуу эмчилэхэд ● Хүхрийн хүчил үйлдвэрлэхэд ● Шүдэнзний толгой хар дарь бэлтгэхэд
- 14. Усыг хоол хүнс,хувцас болон ахуйн өргөн хэрэглээ, энерги хангамж ,үйлдвэрлэл, техникийн гэсэн үндсэн зориулалтаар ашиглаж болно. Дэлхийн гадаргуугийн гуравны хоёр нь усаар бүрхэгдсэн байдаг Дэлхий дээрх усны нийт нөөцийн 97.4 хувийг далайн давстай ус, үлдсэнийг нь өндөр уулын цас мөс эзэлдэг
- 15. Мод ургамлыг исэлдүүлэн спирт үйлдвэрлэдэг. Үйлдвэрлэсэн спиртийг бензинтэй хольж гарган авдаг түлш нь Бразил мэтийн ургамлын биомасс арвинтай улс орнуудад хэрэглэгдэж эхэлж байна.
- 16. Хүхрийн электрон байгууламжийн томьёо бич P +1 P+1 Нунтаг хүхрийг буцалтал нь халаахад хар хүрэн өнгөтэй шингэн болно. Буцалж буй шингэн хүхрийг хүйтэн устай саванд юүлнэ.
- 17. Лити нь 2 атомаас тогтоно. Li ийн электрон байгууламжийн томьёо бич Li2
- 19. Хлор нь 2 атомаас тогтоно.Үүний электрон байгууламжийн томьёо бич Cl2
- 20. H2O2 NH3 NaOH NaClO I2 Дээрх бодисуудыг юунд хэрэглэх вэ ?
- 21. 2 1 Физик шинж чанар Электрон байгууламж Атомын тоо Li +1 P+1 P+1
- 22. H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar
- 23. Дараах зургийг ажиглаад ялгааг тайлбарла
- 24. Хими ба физик шинж чанарын онцлог. • Гелийг юунд хэрэглэх вэ?
- 25. Хүчилтөрөгч O2 түүний хэргэлээ.
- 26. Осидууд H + O2 H2O C + O2 CO2 N + O2 NO2 O + O2 O3 SiO2 Si + O2 Fe2O3 Fe + O2 Оксидын хэрэглээ ?
- 27. Лити Фтор
- 28. Химийн урвалын үзэгдэл: Хий ялгарах Тунадас үүсэх Өнгө өөрчлөгдөнө
- 29. Cu + Ag NO3 Ag + Cu(NO3)2
- 30. Ус
- 32. Хүчил
- 33. Суурь
- 34. pH- уусмалын орчин H ион + Давсны гидродиз 1 2 3 4 5 6 7 8 9 10 11 12 хүчил ус H+1 ион. H+1 ион Гидроксид OH+1 ион.
- 35. pH H2O H+ 1 10 1 HCl Давсны хүчил 2 100 1 H2SO4 Хүхрийн хүчил HNO3 Азотын хүчил 3 1000 1 CH3COOH цууны хүчил H2CO3 нүүрсний хүчил
- 36. Химийн урвал
- 37. CH4 + O2 CO2+ 1 4 2 1 2 H2 1 O 2
- 38. CH4 + O2 CO2+ 2 1 4 2 1 2 H2 1 O 2 4 2
- 39. CH4 2 O2 + CO2+ 2 1 4 2 1 2 H2 1 O 2 4 4 2
- 40. 2Ag + Cl2 2AgCl 1 2 1 1 Урвалд орсон бодисын масс урвалаас үүссэн бодисын масстай тэнуүү
- 41. LiCl + Na +1 NaCl + Li +1 Na + Cl2 NaCl H2O2 H 2 O + O2 KI + Mg+2 MgI2 + K+1 AgNO3+ NaCl AgCl + NaNO3 LiCl + NaOH NaCl + LiOH
- 42. шатах урвал 2 CO + O2 Pt 2 CO2 Атом ба молекул
- 43. Химийн урвал гэж юуг хэлэх вэ?
