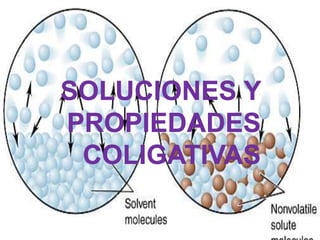
Soluciones y propiedades coligativas
•Descargar como PPTX, PDF•
0 recomendaciones•1,889 vistas
mapa conceptual
Denunciar
Compartir
Denunciar
Compartir
Recomendados
Obtención e identificación de proteínas encontradas en la leche y en la clar...

Obtención e identificación de proteínas encontradas en la leche y en la clar...Renato Andrade Cevallos
Más contenido relacionado
La actualidad más candente
Obtención e identificación de proteínas encontradas en la leche y en la clar...

Obtención e identificación de proteínas encontradas en la leche y en la clar...Renato Andrade Cevallos
La actualidad más candente (20)
Obtención e identificación de proteínas encontradas en la leche y en la clar...

Obtención e identificación de proteínas encontradas en la leche y en la clar...
Destacado
Destacado (20)
Mapa Conceptual sobre Soluciones y Propiedades Coligativas

Mapa Conceptual sobre Soluciones y Propiedades Coligativas
Propiedades coligativas de las disoluciones (química)

Propiedades coligativas de las disoluciones (química)
Plan de gestion para el uso educativo de las tic anzoategui

Plan de gestion para el uso educativo de las tic anzoategui
Último
Último (10)
Presentación guía sencilla en Microsoft Excel.pptx

Presentación guía sencilla en Microsoft Excel.pptx
Global Azure Lima 2024 - Integración de Datos con Microsoft Fabric

Global Azure Lima 2024 - Integración de Datos con Microsoft Fabric
Proyecto integrador. Las TIC en la sociedad S4.pptx

Proyecto integrador. Las TIC en la sociedad S4.pptx
POWER POINT YUCRAElabore una PRESENTACIÓN CORTA sobre el video película: La C...

POWER POINT YUCRAElabore una PRESENTACIÓN CORTA sobre el video película: La C...