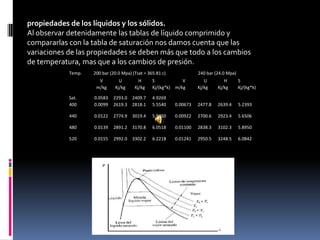
Propiedades de líquidos y sólidos bajo presión y temperatura
- 1. propiedades de los líquidos y los sólidos. Al observar detenidamente las tablas de líquido comprimido y compararlas con la tabla de saturación nos damos cuenta que las variaciones de las propiedades se deben más que todo a los cambios de temperatura, mas que a los cambios de presión.
- 2. temperatura nos de cómo resultado pequeños cambios en el volumen específico, algo similar ocurre con otras propiedades, esto nos indica que como una aproximación podemos utilizar datos de líquido saturado para estados de líquido comprimido tomando como base la misma temperatura. v(T,P) ≈ v f (T) u(T,P) ≈ u f (T) Para la entalpía, la contribución de la presión puede ser importante, por lo que la aproximación se plantea en base a la definición de esta: h(T, P) ≈ uf (T) + Pv f (T) alternativamente se puede expresar como: h(T, P) ≈ h f (T)+ v f (T)[P-Psat(T)]
- 3. si la contribución de la presión al valor de entalpía no es importante, esta expresión puede reducirse a: h(T,P) ≈ h f (T) Como hemos visto, hay regiones donde el volumen específico varía poco y la energía interna varía principalmente con la temperatura, este comportamiento se observa principalmente en la fase líquida y en sólidos, por tanto es conveniente tratar este caso como particular. Se plantea el modelo de las sustancias incompresibles, la cual tiene las propiedades de que la densidad o volumen específico no cambia y que la energía interna solo varia con la temperatura.
- 4. ECUACIONES De acuerdo a una energía interna:Cv(t) = du/dT(incompresible )
- 5. ENTALPÍA h( T, P) = u ( T ) + Pv (incompresible)
- 6. SE CUMPLE LOS SIGUIENTE: ∂h/∂T)P= ∂u/∂T
