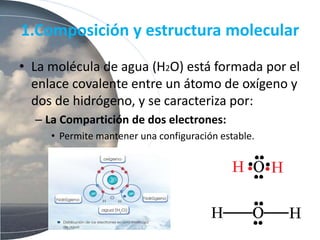
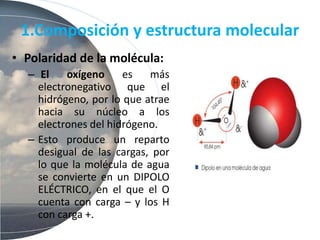
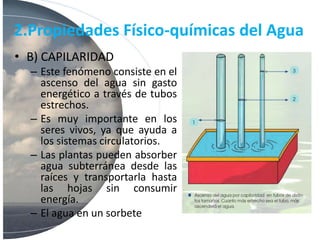
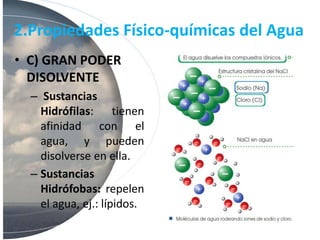
El agua es esencial para la vida debido a su estructura molecular única y propiedades como su polaridad, capacidad de formar puentes de hidrógeno, alto calor específico y poder disolvente. Estas propiedades permiten que el agua transporte nutrientes y moléculas a través de los sistemas biológicos, regule la temperatura de los organismos y su entorno, y disuelva sustancias iónicas y polares.