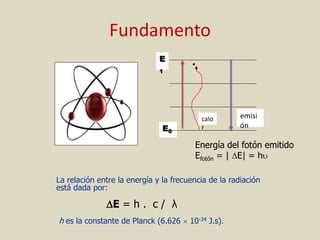
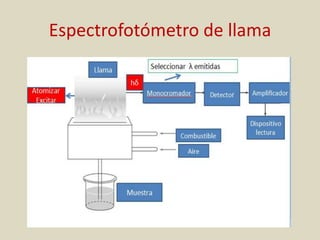
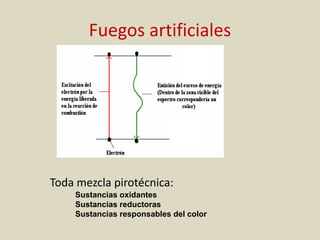
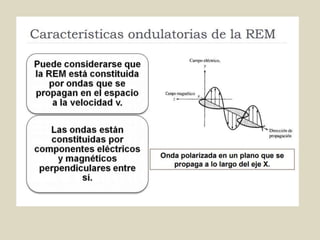
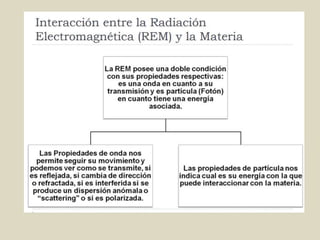
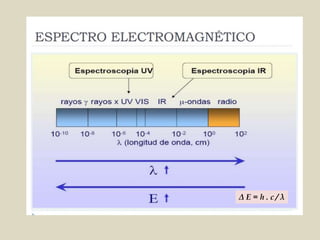
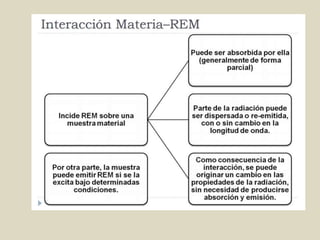
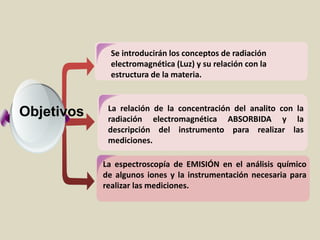
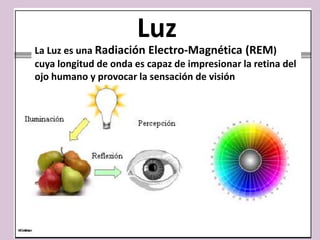
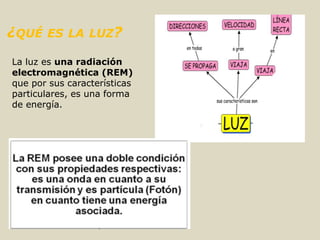
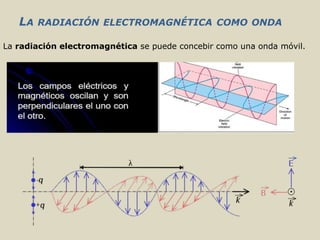
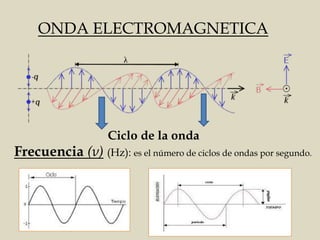
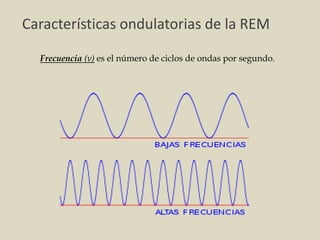
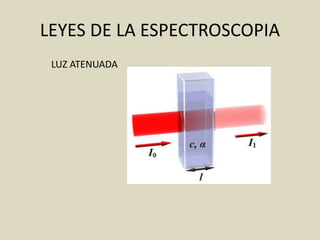
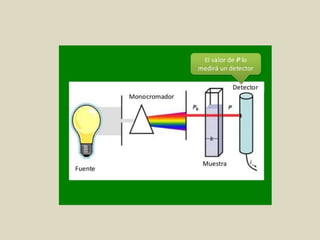
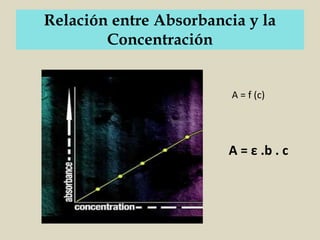
El documento detalla los conceptos fundamentales de la espectroscopía, abordando la relación entre la radiación electromagnética, la estructura de la materia y su aplicación en el análisis químico. Se explica la espectroscopía de absorción y emisión, junto con leyes como la de Beer-Lambert que vinculan la absorbancia con la concentración de analitos. Además, se describen diversos instrumentos y métodos fotométricos para medir la radiación y determinar la presencia de diferentes elementos en soluciones.























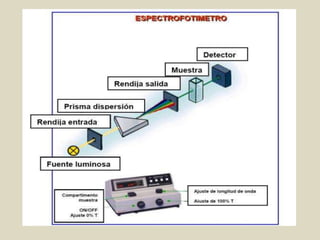


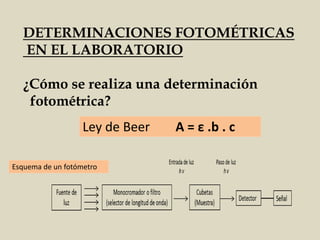
![Espectroscopía de Absorción
Determinación de Hierro
Cátedra de Química Analítica y Agrícola – Facultad de Agronomía - UNT
Solución Patrón: [Fe(NH4)(SO4)2].12H2O
Concentración: 1mg/ml
1 ml
2 ml 3 ml
4 ml
5 ml
0.1 mg/ml 0.3 mg/ml 0.5 mg/ml
0.4 mg/ml
0.2 mg/ml
Blanco
1 ml de KSCN 4 N](https://image.slidesharecdn.com/presespectro2019-240528113838-ad1cb341/85/espetrometria-absorcion-y-emision-REM-41-320.jpg)