Número de oxidación
•Descargar como PPTX, PDF•
1 recomendación•17,413 vistas
Denunciar
Compartir
Denunciar
Compartir
Más contenido relacionado
La actualidad más candente
La actualidad más candente (20)
Destacado
Destacado (7)
Tabla periódica con los número de oxidación de los elementos más comunes

Tabla periódica con los número de oxidación de los elementos más comunes
REGLAS DE ESTADO DE OXIDACIÓN Y ENLACES QUÍMICOS Lic Javier Cucaita

REGLAS DE ESTADO DE OXIDACIÓN Y ENLACES QUÍMICOS Lic Javier Cucaita
Más de sweet_bee94
Más de sweet_bee94 (10)
Número de oxidación
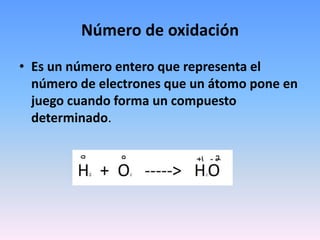
- 1. Número de oxidación • Es un número entero que representa el número de electrones que un átomo pone en juego cuando forma un compuesto determinado.
- 2. • El número de oxidación es positivo si el átomo pierde electrones, o los comparte con un átomo que tenga tendencia a captarlos. Y será negativo cuando el átomo gane electrones, o los comparta con un átomo que tenga tendencia a cederlos.
- 3. • En los iones monoatómicos la carga eléctrica coincide con el número de oxidación. Cuando nos refiramos al número de oxidación el signo + o - lo escribiremos a la izquierda del número, como en los números enteros.