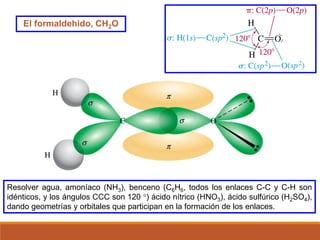
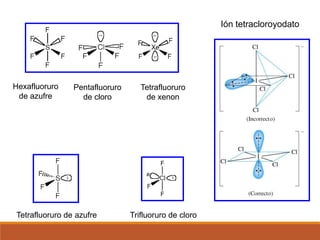
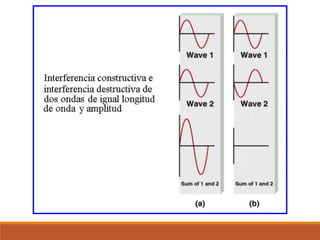
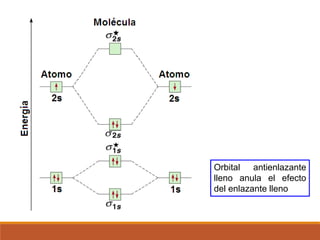
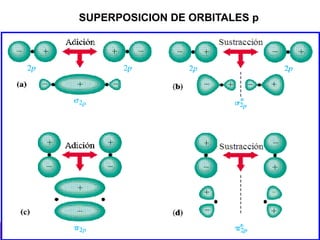
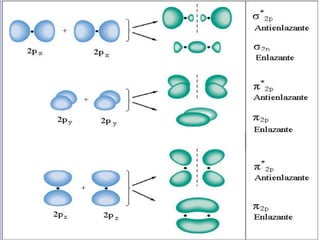
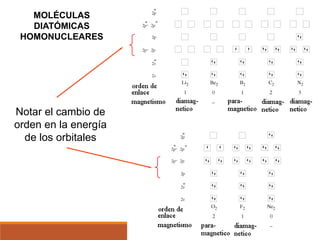
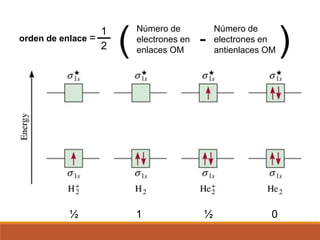
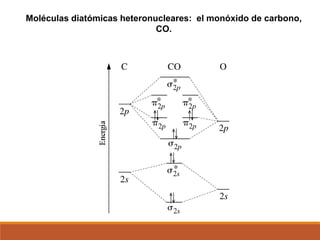
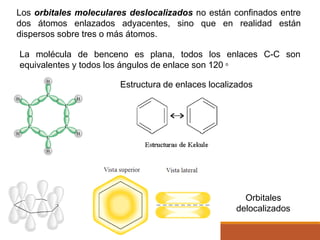
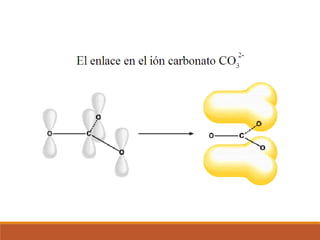
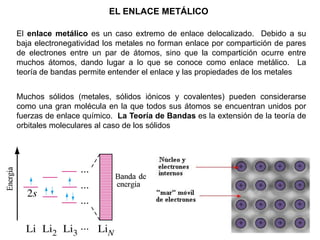
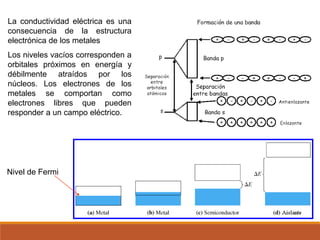
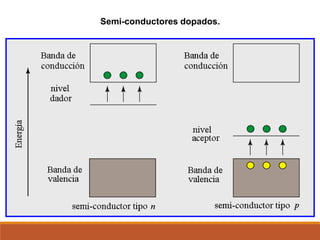
Este documento presenta conceptos clave sobre la teoría del enlace químico, incluyendo:
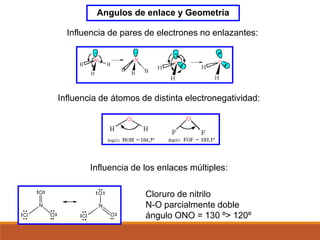
1) La teoría de enlace de valencia y cómo explica la geometría molecular de NH3.
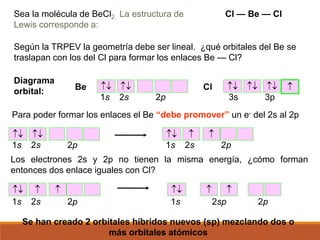
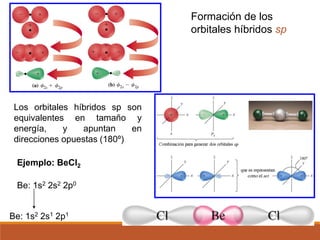
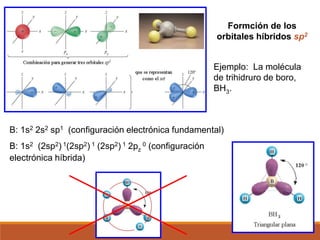
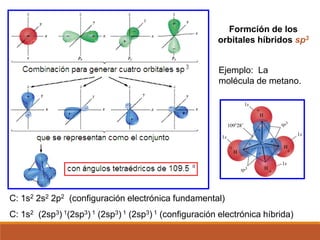
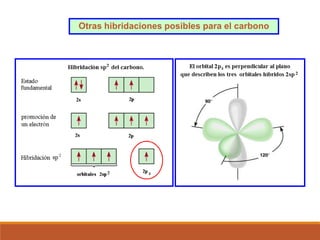
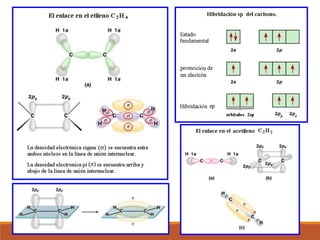
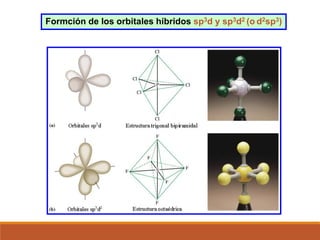
2) La hibridación de orbitales y cómo forma nuevos orbitales híbridos para explicar la geometría de moléculas como BeCl2.
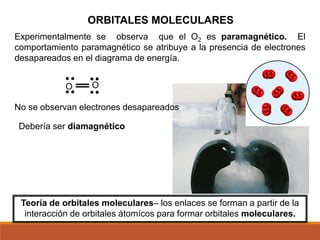
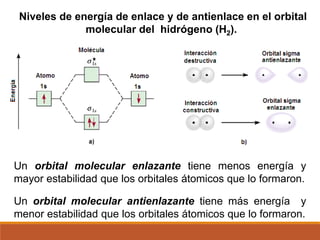
3) La teoría de orbitales moleculares y cómo los orbitales atómicos se combinan para formar orbitales moleculares enlazantes y antienlazantes.