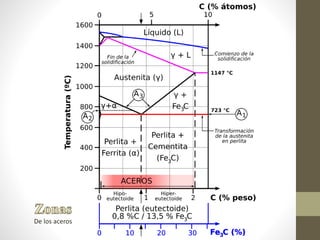
El documento describe el diagrama de hierro-carbono y las propiedades del hierro y sus aleaciones. Explica que el hierro puro tiene diferentes formas alotrópicas (alfa, gamma, delta) dependiendo de la temperatura, y que al alearse con carbono forma acero u otras aleaciones. También resume las fases, puntos críticos y propiedades del diagrama de equilibrio hierro-carbono.


![Símbolo: Fe
Número atómico: 26
Configuración electrónica: [Ar] 4s2 3d6
MA = 55,847
d = 7,87 g.cm-3
PF = 1535ºC
PE = 2750ºC.
Número de protones/electrones: 26
Número de neutrones: 30
Clasificación: Metal de transición
Color: plateado.
Símbolo de Origen: proveniente de la palabra latina Ferrum
(hierro)
Usos: acero, hemoglobina (transporta oxígeno en la sangre)
Obtenido de: minerales de hierro
Acero, mezcla de hierro
Con el carbono](https://image.slidesharecdn.com/diagramadehierrocarbono-190825162500/85/Diagrama-de-hierro-carbono-3-320.jpg)