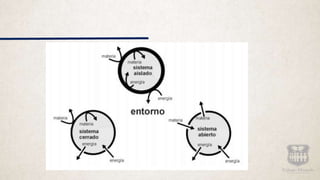
Este documento resume conceptos clave de la termodinámica como sistema, frontera, entorno, calor, temperatura, trabajo, energía interna, equilibrio térmico, y las leyes de la termodinámica. Explica que la termodinámica estudia la transformación del calor en trabajo mecánico y viceversa a través de máquinas térmicas. Resume las tres leyes de la termodinámica, incluyendo que es imposible construir una máquina de movimiento perpetuo o transferir calor de un cuerpo frío