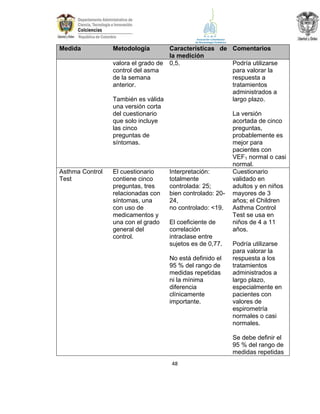
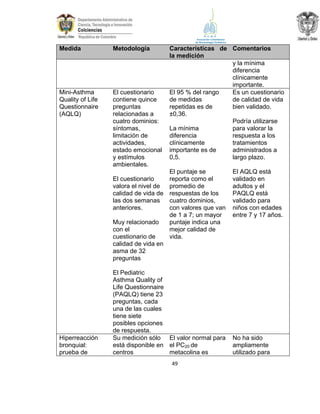
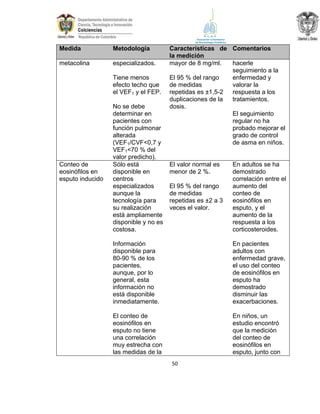
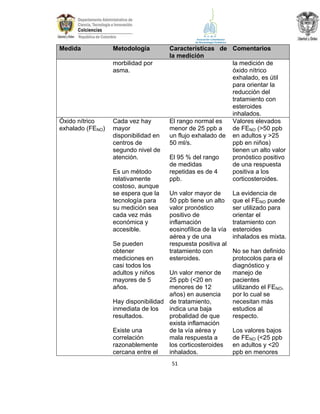
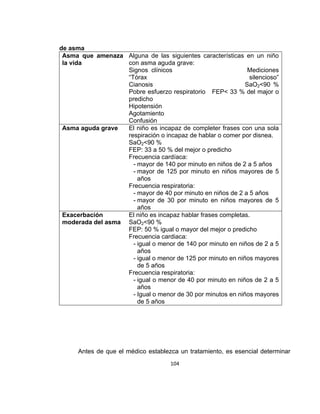
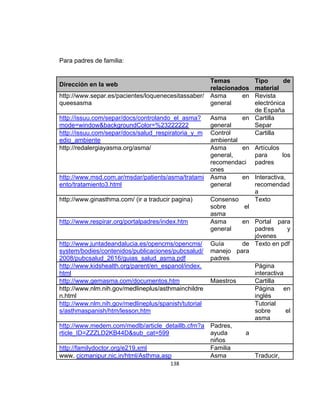
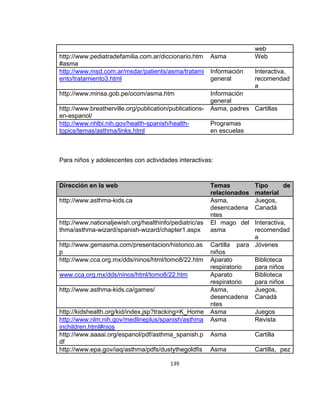
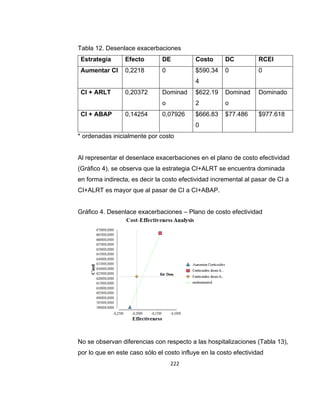
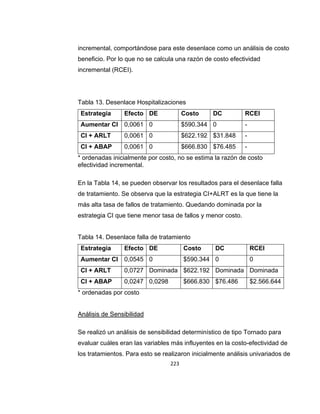
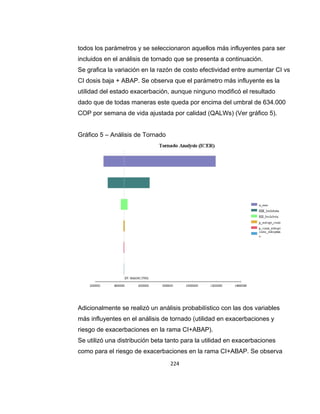
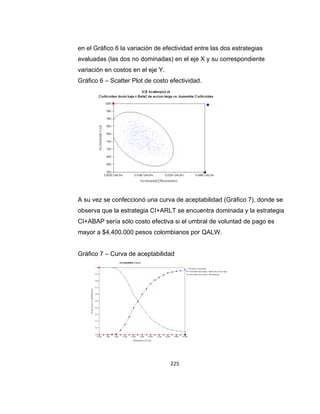
La guía de práctica clínica para el diagnóstico y manejo de niños con asma en Colombia proporciona un enfoque integral para la atención de esta enfermedad crónica, que afecta significativamente la calidad de vida y presenta altas tasas de morbilidad y mortalidad. Incluye recomendaciones para diagnóstico, tratamiento y seguimiento, además de brindar pautas para la educación de pacientes y cuidadores. Esta guía es un esfuerzo colaborativo entre varias entidades y profesionales de la salud, con el objetivo de mejorar el manejo del asma en la infancia.



















![National Asthma Education and Prevention Program (NAEPP)], evaluacion de
tecnologías sanitarias y otras disponibles que se consideraron apropiadas de tener
en cuenta. Con base en lo anterior y con la aplicación de la matriz de decisión –
adaptación o desarrollo de novo de guías de práctica clínica– se decidió adaptar
para Colombia las guías de atención integral de la BTS y el NAEPP, tomando
como prioritaria para la adaptación la guía de atención integral de la BTS; en el
área de terapia respiratoria e inhaloterapia, las preguntas se respondieron de novo
por no encontrar la mejor información (evidence) y aplicabilidad para nuestro
medio.
Esta guía de práctica clínica tiene cuatro productos finales :
1. la guía de práctica clínica completa;
2. la guía de práctica clínica, versión resumida; contiene todas las
recomendaciones clínicas y económicas de la completa; está dirigida a
los trabajadores del sistema de salud y a las entidades del SGSSS;
3. la guía de práctica clínica, versión rápida, con formato práctico para el
usuario, algoritmos simples; recomendaciones con ajustes dependiendo
de la audiencia, y
4. la guía de práctica clínica para padres y pacientes.
Estas versiones se pueden consultar en la página web del Ministerio de
Salud y Protección Social y en la de la Asociación Colombiana de Neumología
Pediátrica.
1.5.2
Aspectos clínicos no cubiertos por la guía
1. Métodos diagnósticos no disponibles en la actualidad en nuestro país
que no son relevantes para el diagnóstico y que no han demostrado un
adecuado perfil de costo-efectividad en otros países.
2. Opciones terapéuticas no disponibles en la actualidad en nuestro país
que no han demostrado ser eficaces, ni tener un adecuado perfil de
costo-efectividad en otros países.
Soporte para auditoría en la guía
La guía de atención integral será revisada cada año en la sección de
tratamiento. Las demás secciones se revisarán y actualizarán cada 2 años, a
menos que sea necesario por el advenimiento de nuevos métodos diagnosticos.
Esta guía de práctica clínica está actualizada a febrero de 2012.
Información adicional
Esta información está disponible como archivo en formato pdf en el sitio
web del Ministerio de Salud y Protección Social y de la Asociación Colombiana de
25](https://image.slidesharecdn.com/gpc01prestsaluasma-131203131406-phpapp01/85/Gpc-01prest-salu-asma-23-320.jpg)





































































































































![295.
Pharmacological management of asthma. Evidence table 4.4a: inhaled
corticosteroid vs theophylline. In: guideline Bgotmoaanc, editor. Edinburgh:
SIGN2002.
296. Newcastle upon Tyne: University of Newcastle upon Tyne CfHSR. Table 16:
nedocromil and sodium cromoglycate studies not included in the nedocromil metaanalysis. In: North of England Evidence Based Guideline Development Project,
editor. In: adults Tpcmoai, editor. Newcastle1999.
297. Pharmacological management of asthma. Evidence table 4.4j: Do cromones
works as first line preventor in children >5 years? . Edinburgh:SIGN;2002;
Available
from:
http://www.sign.ac.uk/guidelines/published/support/guideline63/index.html.
298. Pharmacological management of asthma. Evidence table 4.24a:
Other preventor
therapies
Chromones
in
children
aged
5-12.
Edinburgh:SIGN;2005;
Available
from:
http://www.sign.ac.uk/guidelines/published/support/guideline63/index.html.
299. Van Ganse E, Kaufman L, Derde MP, Yernault JC, Delaunois L, Vincken W.
Effects of antihistamines in adult asthma: a meta-analysis of clinical trials. Eur
Respir J. 1997;10(10):2216-24.
300. Medicines and Healthcare products Regulatory Agency. . 2010. [cited 14
January].
Available
from:
http://www.mhra.gov.uk/Safetyinformation/DrugSafetyUpdate/CON093845.
301. Pharmacological management of asthma. Evidence table 4.11b: Addon drugs for inhaled steroids: long acting or oral B2 agonists. Edinburgh:
SIGN;2002;
Available
from:
http://www.sign.ac.uk/guidelines/published/support/guideline63/index.html.
302. Pharmacological management of asthma. Evidence table 4.11a: Addon
drugs for inhaled steroids: cromones. Edinburgh: SIGN;2002; Available from:
http://www.sign.ac.uk/guidelines/published/support/guideline63/index.html.
303. Pharmacological management of asthma. Evidence table 4.11b: Addon drugs for inhaled steroids: long acting or oral B2 agonists. Edinburgh
SIGN2002.
304. Becker AB, Simons FE. Formoterol, a new long-acting selective beta 2adrenergic receptor agonist: double-blind comparison with salbutamol and placebo
in children with asthma. J Allergy Clin Immunol. 1989;84(6 Pt 1):891-5.
305. Pearlman D, Qaqundah P, Matz J, Yancey SW, Stempel DA, Ortega HG.
Fluticasone propionate/salmeterol and exercise-induced asthma in children with
persistent asthma. Pediatr Pulmonol. 2009;44(5):429-35.
306. Pharmacological management of asthma. Evidence table 4.8c: Children with
poor asthma control on ICS - is addition of leukotriene receptor antagonists
helpful? Edinburgh: SIGN2002.
307. Pharmacological management of asthma. Evidence table 4.8c: Children with
poor asthma control on ICS - is addition of leukotriene receptor antagonists
172](https://image.slidesharecdn.com/gpc01prestsaluasma-131203131406-phpapp01/85/Gpc-01prest-salu-asma-170-320.jpg)
![helpful?
Edinburgh:
SIGN;2002;
Available
from:
http://www.sign.ac.uk/guidelines/published/support/guideline63/index.html.
308. Joos S, Miksch A, Szecsenyi J, Wieseler B, Grouven U, Kaiser T, et al.
Montelukast as add-on therapy to inhaled corticosteroids in the treatment of mild to
moderate asthma: a systematic review. Thorax. 2008;63(5):453-62.
309. Pharmacological management of asthma. Evidence table 4.11d: Addon drugs
for
inhaled
steroids:
theophylline,
beclometasone
diproponate, budesonide. .
Edinburgh:
SIGN;2002;
Available
from:
http://www.sign.ac.uk/guidelines/published/support/guideline63/index.html.
310. Medicines and Healthcare products Regulatory Agency. . In: guideline.
Bgotmoaanc, editor. 2010. [cited 14 January].
311. McMahon AW, Levenson MS, McEvoy BW, Mosholder AD, Murphy D. Age
and risks of FDA-approved long-acting β₂-adrenergic receptor agonists. Pediatrics.
2011;128(5):e1147-54.
312. Robinson CA. FDA's recommendations on the use of long-acting {beta}2
agonists in the management of asthma. Ann Pharmacother. 2010;44(10):1651-4.
313. Pharmacological management of asthma. Evidence table 4.22: Combined
therapy of inhaled steroids and long acting B2 agonists. . Edinburgh: SIGN;2002;
Available
from:
http://www.sign.ac.uk/guidelines/published/support/guideline63/index.html.
314. National Institute for Health and Clinical Excellence (NICE). Corticosteroids
for the treatment of chronic asthma in children under the age of 12 years. . In:
2007, editor. London: NICE.
315. Holgate ST, Chuchalin AG, Hebert J, Lotvall J, Persson GB, Chung KF, et
al. Efficacy and safety of a recombinant anti-immunoglobulin E antibody
(omalizumab) in severe allergic asthma. Clin Exp Allergy. 2004;34(4):632-8. Epub
2004/04/15.
316. Holgate S, Casale T, Wenzel S, Bousquet J, Deniz Y, Reisner C. The antiinflammatory effects of omalizumab confirm the central role of IgE in allergic
inflammation. J Allergy Clin Immunol. 2005;115(3):459-65.
317. Busse W, Corren J, Lanier BQ, McAlary M, Fowler-Taylor A, Cioppa GD, et
al. Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the
treatment of severe allergic asthma. J Allergy Clin Immunol. 2001;108(2):184-90.
318. Lanier B, Bridges T, Kulus M, Taylor AF, Berhane I, Vidaurre CF.
Omalizumab for the treatment of exacerbations in children with inadequately
controlled allergic (IgE-mediated) asthma. J Allergy Clin Immunol.
2009;124(6):1210-6.
319. Humbert M, Beasley R, Ayres J, Slavin R, Hébert J, Bousquet J, et al.
Benefits of omalizumab as add-on therapy in patients with severe persistent
asthma who are inadequately controlled despite best available therapy (GINA 2002
step 4 treatment): INNOVATE. Allergy. 2005;60(3):309-16.
173](https://image.slidesharecdn.com/gpc01prestsaluasma-131203131406-phpapp01/85/Gpc-01prest-salu-asma-171-320.jpg)







![423. Hyvärinen MK, Kotaniemi-Syrjänen A, Reijonen TM, Korhonen K, Korppi
MO. Teenage asthma after severe early childhood wheezing: an 11-year
prospective follow-up. Pediatr Pulmonol. 2005;40(4):316-23.
424. Fagan JK, Scheff PA, Hryhorczuk D, Ramakrishnan V, Ross M, Persky V.
Prevalence of asthma and other allergic diseases in an adolescent population:
association with gender and race. Ann Allergy Asthma Immunol. 2001;86(2):17784.
425. Duse M, Donato F, Porteri V, Pirali F, Spinoni V, Tosoni C, et al. High
prevalence of atopy, but not of asthma, among children in an industrialized area in
North Italy: the role of familial and environmental factors--a population-based
study. Pediatr Allergy Immunol. 2007;18(3):201-8.
426. Annesi-Maesano I, Oryszczyn MP, Raherison C, Kopferschmitt C, Pauli G,
Taytard A, et al. Increased prevalence of asthma and allied diseases among active
adolescent tobacco smokers after controlling for passive smoking exposure. A
cause for concern? Clin Exp Allergy. 2004;34(7):1017-23.
427. Larsson L. Incidence of asthma in Swedish teenagers: relation to sex and
smoking habits. Thorax. 1995;50(3):260-4.
428. Goodwin RD, Fergusson DM, Horwood LJ. Asthma and depressive and
anxiety disorders among young persons in the community. Psychol Med.
2004;34(8):1465-74.
429. Richardson LP, Lozano P, Russo J, McCauley E, Bush T, Katon W. Asthma
symptom burden: relationship to asthma severity and anxiety and depression
symptoms. Pediatrics. 2006;118(3):1042-51.
430. Sopo SM, Radzik D, Calvani M. Does treatment with proton pump inhibitors
for gastroesophageal reflux disease (GERD) improve asthma symptoms in children
with asthma and GERD? A systematic review. J Investig Allergol Clin Immunol.
2009;19(1):1-5.
431. Gibson PG, Henry RL, Coughlan JL. Gastro-oesophageal reflux treatment
for asthma in adults and children. Cochrane Database Syst Rev.
2003(2):CD001496.
432. Castro-Rodríguez JA. [Relationship between obesity and asthma]. Arch
Bronconeumol. 2007;43(3):171-5.
433. Schaub B, von Mutius E. Obesity and asthma, what are the links? Curr Opin
Allergy Clin Immunol. 2005;5(2):185-93.
434. Rodríguez MA, Winkleby MA, Ahn D, Sundquist J, Kraemer HC.
Identification of population subgroups of children and adolescents with high asthma
prevalence: findings from the Third National Health and Nutrition Examination
Survey. Arch Pediatr Adolesc Med. 2002;156(3):269-75.
435. Brenner JS, Kelly CS, Wenger AD, Brich SM, Morrow AL. Asthma and
obesity in adolescents: is there an association? J Asthma. 2001;38(6):509-15.
436. Gilliland FD, Berhane K, Islam T, McConnell R, Gauderman WJ, Gilliland
SS, et al. Obesity and the risk of newly diagnosed asthma in school-age children.
Am J Epidemiol. 2003;158(5):406-15.
181](https://image.slidesharecdn.com/gpc01prestsaluasma-131203131406-phpapp01/85/Gpc-01prest-salu-asma-179-320.jpg)
























![and Blood Institute de los Estados Unidos de Norteamérica para la Guía de
diagnóstico y manejo del asma(8) se decidió actualizar la misma desde su
última versión, en Marzo de 2006, hasta el 31 de Octubre de 2011.
Se consultaron las bases de datos de Medline, Embase y Cochrane. El
esquema general de los descriptores utilizados fue:
(grupo de fármacos)
AND
{(randomized controlled trial [pt] OR controlled clinical trial [pt] OR
randomized controlled trials [mh] OR random allocation [mh] OR
double-blind method [mh] OR single-blind method [mh]) NOT
(animals [mh] NOT human [mh])}
OR
{(systematic review[tiab] OR Meta-Analysis[pt] OR Meta-Analysis as
Topic[mh] OR Meta-Analys*[tiab] OR "Cochrane Database Syst
Rev"[Journal:__jrid21711])}
Limits: All Child: 0-18 years
Como se observa, se incluyeron solamente estudios aleatorizados o
revisiones sistemáticas o metanálisis en humanos. Inicialmente se
incluyeron niños de 0 a 18 años como una estrategia de búsqueda más
sensible, para ser refinada posteriormente por revisión manual de los textos
recuperados. Las estrategias específicas para cada grupo de fármacos
considerados se incluyen en el apéndice.
Se obtuvieron los siguientes resultados para cada grupo de fármacos:
•
Agonistas β2 adrenérgicos - ECA (ensayos clínicos aleatorizados) =
506 referencias
207](https://image.slidesharecdn.com/gpc01prestsaluasma-131203131406-phpapp01/85/Gpc-01prest-salu-asma-205-320.jpg)



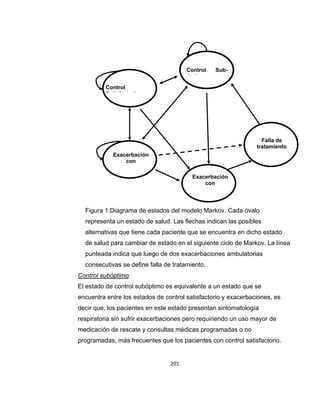
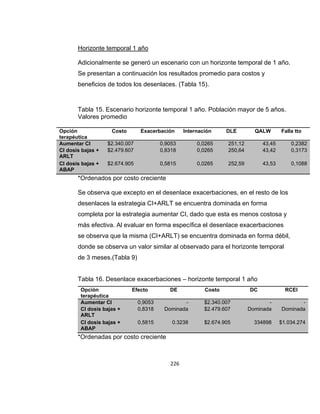
![una cantidad de días libres de síntomas para cada uno de los estados (ver
Tabla 6).
Calidad de Vida - Utilidades
Los resultados de este componente se reportan para cada grupo en
semanas ajustadas por calidad de vida (SACV; en inglés QALWs).
Se realizó una búsqueda de estudios en PubMed en Febrero de 2012
utilizando la siguiente estrategia de búsqueda:
(Quality-Adjusted Life Years[Mesh] OR QALY*[tiab] OR Adjusted Life[tiab]
OR Quality-Adjusted[tiab]) AND (Asthma[Mesh] OR Asthma*[tiab]) AND
(Child[Mesh] OR children[tiab]).
Tabla 6. Ponderaciones de preferencias/utilidades y días libres de síntomas
para los distintos estados de salud
211](https://image.slidesharecdn.com/gpc01prestsaluasma-131203131406-phpapp01/85/Gpc-01prest-salu-asma-209-320.jpg)
















![
Referencias
1.
World Health Organization. Asthma Fact sheet N°307. 2011.
2.
Mallol J. El asma en niños de América Latina. Allergol Immunopathol
(Madr). 2004;32(03):100–3.
3.
Vergara C, Caraballo L. Algunas características epidemiológicas del
asma en una región tropical. Rev. colomb. neumol. 1995;7(4):187–
91.
4.
Nogueira K, Silva J, Lopes C. Quality of life of asthmatic adolescents:
assessment of asthma severity, comorbidity, and life style. J Pediatr
(Rio J). 2009;85(6):523–30.
5.
Cisneros C, García-Río F, Romera D, Villasante C, Girón R,
Ancochea J. Bronchial reactivity indices are determinants of healthrelated quality of life in patients with stable asthma. Thorax.
2010;65(9):795–800.
6.
Ferraris F, et al. Utilización de recursos y costos médicos directos de
las enfermedades crónicas en una población pediátrica argentina.
Arch Argent Pediatr. 2011;109(3):213–8.
7.
Global Initiative for Asthma. Global Strategy for Asthma Management
and Prevention. 2010.
8.
National Asthma Education and Prevention Program. Expert Panel
Report 3: Guidelines for the Diagnosis and Management of Asthma.
2007.
9.
Ministerio de la Protección Social de la República de Colombia.
Sistema de Información de Precios de Medicamentos (SISMED).
Listado de Precios Promedio y Unidades en la Cadena de
Comercialización de Medicamentos [Internet]. [cited 2012 Apr
1];Available from:
http://www.minproteccionsocial.gov.co/salud/Paginas/Sistema de
Informaci%C3%B3n de Precios de Medicamentos.aspx
10.
Jat GC, Mathew JL, Singh M. Treatment with 400 microg of inhaled
budesonide vs 200 microg of inhaled budesonide and oral
montelukast in children with moderate persistent asthma: randomized
controlled trial. Ann Allergy Asthma Immunol. 2006;97(3):397–401.
237](https://image.slidesharecdn.com/gpc01prestsaluasma-131203131406-phpapp01/85/Gpc-01prest-salu-asma-235-320.jpg)
![11.
Kondo N, Katsunuma T, Odajima Y, Morikawa A. A randomized
open-label comparative study of montelukast versus theophylline
added to inhaled corticosteroid in asthmatic children. Allergol Int.
2006;55(3):287–93.
12.
Gappa M, Zachgo W, von Berg A, Kamin W, Stern-Strater C,
Steinkamp G. Add-on salmeterol compared to double dose
fluticasone in pediatric asthma: a double-blind, randomized trial
(VIAPAED). Pediatr Pulmonol. 2009;44(11):1132–42.
13.
Verini M, Peroni DG, Piacentini GL, Nicodemo A, Rossi N, Bodini A,
et al. Comparison of add-on therapy to inhaled fluticasone propionate
in children with asthma: residual volume and exhaled nitric oxide as
outcome measures. Allergy Asthma Proc. 2007;28(6):691–4.
14.
Drummond M, Sculpher M, Torrance G, O’Brien B, Stoddart G.
Methods for the Economic Evaluation of Health Care Programmes.
3rd ed. Oxford: Oxford University Press; 2005.
15.
Ministerio de la Protección Social - COLCIENCIAS. Guía
Metodológica para la elaboración de Guías de Atención Integral en el
Sistema General de Seguridad Social en Salud colombiano. Bogotá:
2010.
16.
Price M, Briggs A. Development of an Economic Model to Assess the
Cost Effectiveness of Asthma Management Strategies.
Pharmacoeconomics. 2002;20(3):183–94.
17.
Dewilde S, Turk F, Tambour M, Sandström T. The economic value of
anti-IgE in severe persistent, IgE-mediated (allergic) asthma patients:
adaptation of INNOVATE to Sweden. Current medical research and
opinion [Internet]. 2006 Sep [cited 2012 Apr 6];22(9):1765–76.
Available from: http://www.ncbi.nlm.nih.gov/pubmed/16968580
18.
Rodríguez Martínez C, Sossa Briceño M. Análisis de costo-utilidad de
los esteroides inhalados disponibles en Colombia para el manejo de
pacientes pediátricos con asma persistente. Revista Colombiana de
Neumología. 2009;21(1):111–35.
19.
Campbell JD, Spackman DE, Sullivan SD. The costs and
consequences of omalizumab in uncontrolled asthma from a USA
payer perspective. Allergy [Internet]. 2010 Sep [cited 2012 Apr
238](https://image.slidesharecdn.com/gpc01prestsaluasma-131203131406-phpapp01/85/Gpc-01prest-salu-asma-236-320.jpg)
![6];65(9):1141–8. Available from:
http://www.ncbi.nlm.nih.gov/pubmed/20148804
20.
Steuten L, Palmer S, Vrijhoef B. Cost-utility of a disease management
program for patients with asthma. International Journal of Technology
Assessment in HealthCare. 2007;23(2):184–91.
21.
British Thoracic Society. British Guideline on the Management of
Asthma. London: 2011.
22.
Lemanske Jr. RF, Mauger DT, Sorkness CA, Jackson DJ, Boehmer
SJ, Martinez FD, et al. Step-up therapy for children with uncontrolled
asthma receiving inhaled corticosteroids. N Engl J Med.
2010;362(11):975–85.
23.
de Blic J, Ogorodova L, Klink R, Sidorenko I, Valiulis A, Hofman J, et
al. Salmeterol/fluticasone propionate vs. double dose fluticasone
propionate on lung function and asthma control in children. Pediatr
Allergy Immunol. 2009;20(8):763–71.
24.
Vaessen-Verberne AA, van den Berg NJ, van Nierop JC, Brackel HJ,
Gerrits GP, Hop WC, et al. Combination therapy
salmeterol/fluticasone versus doubling dose of fluticasone in children
with asthma. Am J Respir Crit Care Med. 2010;182(10):1221–7.
25.
Murray CS, Custovic A, Lowe LA, Aldington S, Williams M, Beasley
R, et al. Effect of addition of salmeterol versus doubling the dose of
fluticasone propionate on specific airway resistance in children with
asthma. Allergy Asthma Proc. 2010;31(5):415–21.
26.
Glaxo Smith Kline. A multicentre, randomised, double-blind, doubledummy, parallel group comparison of three treatments : 1)
salmeterol/fluticasone propionate (SFC) (50/100mcg strength) bd via
DISKUS/ACCUHALER inhaler, 2) fluticasone propionate 200mcg bd
via DISKUS/ACCUHALE [Internet]. 2004 [cited 2012 Apr 1];Available
from: http://www.gskclinicalstudyregister.com/result_detail.jsp;jsessionid=21B1EDACC3C
C03954257B584FFAA297D?protocolId=SAM40012&studyId=976DC
E26-49E4-48CD-9D7F4857B4B2490E&compound=fluticasone+propionate%2Fsalmeterol
27.
Verberne AAPH, Frost C, Duiverman EJ, Grol MH, Kerrebijn KF,
Respiratory P, et al. Addition of Salmeterol versus Doubling the Dose
239](https://image.slidesharecdn.com/gpc01prestsaluasma-131203131406-phpapp01/85/Gpc-01prest-salu-asma-237-320.jpg)
![of Beclomethasone in Children with Asthma. Am J Respir Crit Care
Med. 1998;158(1):213–9.
28.
Tarride JE, Burke N, Bischof M, et al. A review of health utilities
across conditions common in paediatric and adult populations. Health
Qual Life Outcomes. 2010;8:12.
29.
Banco de la República de Colombia. Serie empalmada de la tasa de
cambio del peso colombiano frente al dólar (TRM y Certificado de
cambio) [Internet]. [cited 2012 Apr 1];Available from:
http://www.banrep.gov.co/seriesestadisticas/see_ts_trm.htm#cotización
30.
Macroeconomics and Health: investing in health for economic
development. Sachs J. World Health Organization on
Macroeconomics and Health; 2001. 210 pp.
240](https://image.slidesharecdn.com/gpc01prestsaluasma-131203131406-phpapp01/85/Gpc-01prest-salu-asma-238-320.jpg)
![Apéndice – Estrategia de búsqueda utilizada
Las estrategias de búsqueda específicas para cada grupo de fármacos
fueron las siguientes:
Agonistas β2 adrenérgicos:
(Asthma[Mesh] OR Asthma*[tiab]) AND (Bronchodilator Agents[Mesh] OR
Bronchodilator*[tiab] OR Broncho Dilat*[tiab] OR Bronchodilator
Agents[Pharmacological Action] OR Albuterol[Mesh] OR Albuterol[tiab] OR
Salbutamol[tiab] OR Levalbuterol[tiab] OR Ventolin[tiab] OR Adrenergic
beta-Agonists[Mesh] OR Adrenergic beta[tiab] OR beta-Adrenergic[tiab] OR
Adrenergic beta-Agonists [Pharmacological Action] OR
fluticasone, salmeterol drug combination [Supplementary Concept] OR
salmeterol[Supplementary Concept] OR salmeterol[tiab] OR Phenoterol[tiab]
OR fenoterol[tiab] OR formoterol[Supplementary Concept] OR
formoterol[tiab] OR Metaproterenol[Mesh] OR Metaproterenol[tiab] OR
Terbutaline[Mesh] OR Terbutalin*[tiab] OR Clenbuterol[Mesh] OR
Clenbuterol[tiab])
Antagonistas de receptores de leucotrienos
(Asthma[Mesh] OR Asthma*[tiab]) AND (Leukotriene Antagonists[Mesh] OR
Leukotriene Antagonists[Pharmacological Action] OR
Leukotriene antagonist*[tiab] OR zafirlukast [Supplementary Concept] OR
zafirlukast [tiab] OR montelukast[Supplementary Concept] OR
montelukast[tiab] OR Singulair[tiab] OR pranlukast [Supplementary
Concept] OR pranlukast [tiab])
Corticoides inhalatorios
241](https://image.slidesharecdn.com/gpc01prestsaluasma-131203131406-phpapp01/85/Gpc-01prest-salu-asma-239-320.jpg)
![(Asthma[Mesh] OR Asthma*[tiab]) AND (Inhaled Corticoid*[tiab] OR Inhaled
Corticosteroid*[tiab] OR glucocorticoid*[tiab] OR
Glucocorticoids [Pharmacological Action] OR Ciclesonide[substance name]
OR Fluticasone[substance name] OR Flunisolide[substance name] OR
Flunisolide[tiab] OR Beclomethasone[Mesh] OR Beclomethason*[tiab] OR
fluticasone [Supplementary Concept] OR fluticasone, salmeterol drug
combination [Supplementary Concept] OR fluticason*[tiab] OR
Budesonide[Mesh] OR Budesonid*[tiab] OR mometasone furoate[Substance
Name] OR mometasone[tiab] OR Triamcinolone[Mesh] OR
Triamcinolon*[tiab])
Metilxantinas
(Asthma[Mesh] OR Asthma*[tiab]) AND (Theophylline[Mesh] OR
Theophylline[tiab] OR Theo-Dur[tiab] OR Theodur[tiab] OR Slo-Phyllin[tiab]
OR SloPhyllin[tiab] OR IBMX[tiab] OR 3-Isobutyl-1-methylxanthine[tiab] OR
Aminophyllin*[tiab] OR Ethylenediamin*[tiab] OR Aminodur[tiab] OR OR
Dyphylline[tiab] OR Diprophylline[tiab] OR Xanthinol Niacinate[tiab] OR
Xanthinol Nicotinate[tiab] OR Xantinol-nicotinat*[tiab] OR Sadamin*[tiab])
242](https://image.slidesharecdn.com/gpc01prestsaluasma-131203131406-phpapp01/85/Gpc-01prest-salu-asma-240-320.jpg)