Este documento presenta un libro de texto sobre Química General que utiliza un nuevo enfoque basado en los tres niveles de representación de la materia: macroscópico, submicroscópico y simbólico. El libro incluye capítulos sobre la estructura de la materia, la tabla periódica, los enlaces químicos y la nomenclatura. También presenta estrategias didácticas y anexos adicionales. Fue elaborado por profesores de la Universidad Autónoma de Sinaloa con el objetivo









































































































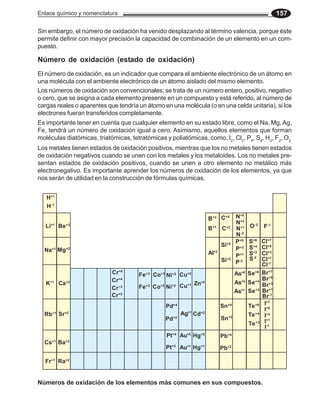
![Estructura de la materia y tabla periódica 107
En la configuración electrónica del 1s 2s 2px 2py 2pz
boro (Z = 5), los orbitales 1s y 2s se
saturan con un par de electrones en ↑↓ ↑
cada orbital, y su electrón diferencial 5
B
se ubica en el orbital 2 px. ↑↓
1s 2s 2px 2py 2pz
En el átomo de carbono (Z = 6), cua-
↑↓ ↑ ↑ tro electrones saturan los orbitales 1s
6
C y 2s, los dos restantes se distribu-
↑↓ yen, uno en el orbital 2 px y el otro en
el orbital 2 py.
¿Sabías qué... a los orbitales que pertenecen a un mismo subnivel se les denomina orbitales
degenerados? Su nombre pudiera llevarnos a pensar otra cosa, sin embargo, se les llama
así, porque tienen energías equivalentes, ejemplo de ello, son los orbitales p,d y f.
3. Configuración tipo kernel
Este tipo de notación nos permite escribir en forma abreviada una configuración electrónica,
que de otra forma sería más extensa.
[ 2He]
El término kernel fue introducido por Lewis y Langmuir, para designar la parte inter-
na del átomo, que quedaría si la separamos de la capa externa de electrones. El
[10Ne]
kernel de cualquier átomo se representa con el símbolo químico y número atómico
del gas noble correspondiente, entre corchetes, cuyo número de electrones sea
[18Ar]
inmediato inferior al del átomo que se desea representar.
Así, la configuración tipo kernel del átomo de cloro, 17Cl es: [10Ne] 3s2 3p5 [36Kr]
Otros ejemplos: Na; [10 Ne] 3s1
11 [54Xe]
Fe; [18 Ar ] 4s2 3d6
26 [86Rn]
35
Br; [18 Ar ] 4s2 3d10 3p5
Actividad 2.16 Usando la notación exponencial, vectorial y tipo
kernel construya la configuración electrónica del fósforo.
Notación exponencial: ___________________________________________
Notación vectorial: ___________________________________________
Notación tipo kernel: ___________________________________________](https://image.slidesharecdn.com/librodequmicageneral-120309091037-phpapp02/85/Libro-de-qumica_general-106-320.jpg)





![Estructura de la materia y tabla periódica 113
15. Desarrolla la configuración electrónica tipo kernel para los siguientes elementos químicos:
12
Mg ________________________________________________________________
16
S ________________________________________________________________
28
Ni ________________________________________________________________
47
Ag ________________________________________________________________
16. Los subniveles de energía son designados por las letras:
a) 1, 2, 3 y 4 b) x, y, z c) s, p, d y f d) a, b, c y d
17. Qué configuración electrónica describe el nivel de energía más externo de un átomo de
molibdeno, (42Mo)
a) 6p6 b) 5s2 c) 5s1 d) 5d4
18. Si el electrón diferencial del nitrógeno (Z=7) se acomoda en 2pz, ¿en cuál orbital se va a
ubicar el electrón diferencial del oxígeno (Z =8)?
19. El último electrón del flúor, (F) ¿en qué orbital se sitúa?______________________________
¿Tiene este elemento todos sus orbitales del segundo nivel saturados?__________________
20. Para el elemento químico sodio, Na (Z =11), ¿será posible ubicar su electrón diferencial en
el segundo nivel de energía?_____________¿Por qué?_____________________________
________________________________________________________________________
21. Exceptuando al helio, todos los átomos de los gases nobles, tienen en su último nivel de
energía…de electrones:
a) duetos de e- b) tríos de e- c) cuartetos e- d) octetos e-
22. El espacio en el cual existe un 99% de probabilidad de encontrar un electrón se denomina:
a)subnivel de energía b) orbital c) nivel de energía d) esfera electrónica
23. La siguiente configuración electrónica 1s2 2s2 2p1 corresponde a:
a) Flúor b) Hidrógeno c) Litio d) Boro
24. ¿Qué elemento tiene una configuración electrónica [Ar] 4s2 3d3
a) Vanadio b) Escandio c) Nitrógeno d) Arsénico
25. ¿Cuál es la configuración electrónica del radón?
a) [Xe]5d8 b) [Xe]6s24f145d106p6 c) [Xe]5s25p6 d) [Rn]6s26p6
26. ¿Cuál es el número máximo de electrones que puede contener un orbital?
a) 1 b) 2 c) 3 d) 4
27. Se dice que el electrón tiene una naturaleza dual, ¿qué significado tiene para tí esto?
________________________________________________________________________
_________________________________________________________________________](https://image.slidesharecdn.com/librodequmicageneral-120309091037-phpapp02/85/Libro-de-qumica_general-112-320.jpg)






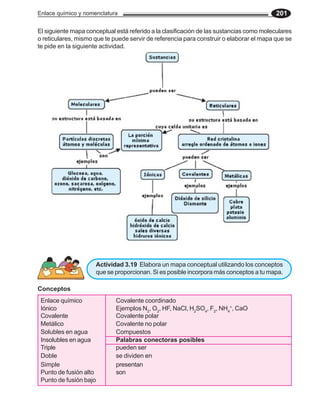
![120 Química General
El nivel más externo es el 4, por tanto,
este elemento pertenece al período 4.
El número de electrones externos son 2, los cua-
les se suman con los del subnivel d, para dar un
total de 11, éste número determina el grupo.
29
Cu 1s2 2s2 2p6 3s2 3p6 4s2 3d9
La configuración electrónica termina en un
subnivel d, por tanto, pertenece al subgrupo B
y al bloque d
La configuración electrónica esperada para el átomo de cobre es [18 Ar ] 4s2 3d9. Sin embargo,
en la configuración real del cobre, hay dos electrones para cada uno de los cinco orbitales del
subnivel 3d, quedando un sólo electrón en el subnivel 4s: [18 Ar ] 4s1 3d10.
Esto se explica porque los orbitales 4s y 3d son casi de la misma energía. Pues bien, si desea-
mos utilizar la configuración electrónica tipo kernel del cobre, tendríamos que al sumar los elec-
trones del último y penúltimo subnivel [18 Ar ] 4s2 3d9, nos da un total de 11, esto coincide con la
numeración arábiga de los grupos, pero cuando deseamos utilizar la numeración romana, en-
tonces la configuración [18 Ar ] 4s1 3d10, nos permite determinar que el grupo es el IB, porque
cuando el subnivel d se encuentra lleno, no se suman sus electrones con los del último nivel.
Así, la información que nos proporciona la configuración electrónica, [18 Ar ] 4s1 3d10 , es que el
cobre (Cu), se encuentra en el grupo IB o grupo11, en el subgrupo B, en el período 4 y en el
bloque d.
Actividad 2.24 Determina con base en la configuración electrónica el
grupo, subgrupo, período y bloque de cada elemento, asímismo, su
ubicación en la tabla periódica.
Configuración electrónica Z Grupo Subgrupo Período Bloque Elemento
1s2 2s2 2p6 3s2 3p6 4s2 3d3
1s2 2s2 2p6 3s2 3p6 4s2 3d1
1s2 2s2 2p6 3s2 3p6 4s2 3d8
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d5
1s2 2s2 2p6 3s2 3p6 4s1 3d5
1s2 2s2 2p6 3s2 3p6 4s2 3d104p6 5s2 4d6
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d2
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d7](https://image.slidesharecdn.com/librodequmicageneral-120309091037-phpapp02/85/Libro-de-qumica_general-119-320.jpg)






















![Estructura de la materia y tabla periódica 143
Actividad 2.29 En forma individual o colaborativa contesta las
siguientes preguntas sobre los elementos representativos, de
transición y transición interna.
1. Estos dos elementos son líquidos en condiciones normales de temperatura y presión.
a) Plata y nitrógeno b) Mercurio y plata c) Mercurio y bromo c) Litio y galio
2. Los elementos que son gases en condiciones normales de temperatura y presión
pertenecen a los ...
a) metales b) metaloides c) actínidos d) no metales
3. ¿Qué par de elementos podría esperarse que tengan propiedades similares?
a) F y Ne b) Mg y Ti c) Si y Ge d) Li y Fe
4. Los gases nobles no son reactivos porque tienen los subniveles s y p llenos de…
a) electrones internos b) neutrones c) electrones externos d) protones
5. Del berilio al radio, podrías esperar que las reactividades de los elementos …
a) permanezcan iguales b) se incrementen y disminuyan
c) se incrementen d) disminuyan
6. ¿Qué características permite a los átomos formar parte de un mismo grupo?
a) Las propiedades físicas similares c) La misma masa atómica
b) El mismo número de electrones de valencia d) El mismo número de orbitales
7. El plutonio y el americio son...
a) metaloides b) no metales c) gases nobles d) actínidos
8. Lantánidos y actínidos se conocen como...
a) elementos de transición interna b) metaloides
c) halógenos d) no metales
9. ¿Cuál de las siguientes configuraciones electrónicas externas es típica de los elementos
alcalinotérreos?
a) ns1 b) ns2 np2 c) ns2 np3 d) ns2
10. A los elementos del bloque d se les conoce como…
a) metales de transición b) metales alcalinos
c) metales alcalinoterreos d) térreos
11. Los halógenos son buenos desinfectantes, ¿cuál de los siguientes elementos es un
halógeno?
a) Cm b) Cl c) Cd d) Cr
12. ¿Cómo se podría clasificar a un elemento que tiene una configuración electrónica [Kr] 5s2
4d10 5p5 ?
a) Elemento representativo b) Metal de transición
c) Metal alcalino d) Gases nobles](https://image.slidesharecdn.com/librodequmicageneral-120309091037-phpapp02/85/Libro-de-qumica_general-142-320.jpg)


![146 Química General
38. ¿Cuál de los siguientes elementos es el menos reactivo químicamente?
a) O2 b) Cl2 c) Na d) F2 e) Xe
39. ¿Qué elementos son constituyentes de las proteínas?
a) C, Zn, H, O, P b) C, H, O, N, S c) C, Fe, Zn, I d) C, O, Tc, N
40. La siguiente configuración electrónica: [54Xe] 6s24f2 pertenece a un elemento que está
dentro de los conocidos como:
a) Metales de transición b) Metales alcalinotérreos
c) Metales de transición interna d) Metales alcalinos
41 Con base en su configuración electrónica o electrón diferencial, actualmente, la tabla periódica
se divide para su estudio en:
a) 3 bloques b) 4 bloques c) 2 bloques d) 1 bloque
42. ¿A qué grupo pertenece el elemento cuya configuración electrónica es: 1s2 2s2 2p5?
a) IIA b) VA c) VIIA d) IIIA
43. ¿A qué bloque pertenece el elemento con número atómico Z = 11?
a) p b) d c) s d) f
44. A estos bloques pertenecen los elementos que se encuentran en los grupos A.
a) Bloque s y d b) Bloque d y f c) Bloque s-p d) Bloque f y d
45. Elemento que se presenta en la naturaleza en dos formas cristalinas alotrópicas: diamante
y grafito.
a) S b) Se c) C d) Cl
46. Es un sólido de color amarillo con números de oxidación; -2, +2, +4 y +6 y su configuración
electrónica es: 1s22s22p63s23p4
a) N b) S c) Se d) P
47. El calcio es a los alcalinotérreos, lo que el potasio es a los...
a) térreos b) alcalinos
c) halógenos d) calcógenos
48. El elemento del grupo 18 que en estado natural se encuentra como un sólido.
a) He b) Ne
c) Kr e) Ninguno de los anteriores
49. El número de oxidación del nitrógeno en estado libre es:
a) +1 b) +2 c) +5 d) cero
50. ¿Cuáles de los siguientes elementos son metales de transición?
a) In b) Tl c) Ca d) He e) Ti f) Sc g) Ce h) Na i) Fe
51. ¿Cuáles de los siguientes elementos son gases a temperatura ambiente?
a) Ne b) S c) B d) Cl e) Br f) H g) N h) Na i) O](https://image.slidesharecdn.com/librodequmicageneral-120309091037-phpapp02/85/Libro-de-qumica_general-145-320.jpg)