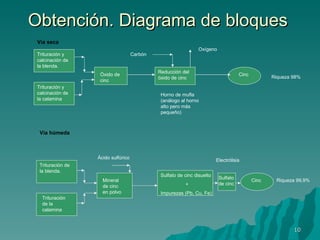
El documento proporciona información sobre el plomo y el cinc, incluyendo sus fichas técnicas, procesos de obtención, propiedades, aleaciones, aplicaciones y repercusiones ambientales. Resume las características clave y usos del plomo y el cinc, así como sus impactos cuando se liberan al medio ambiente.