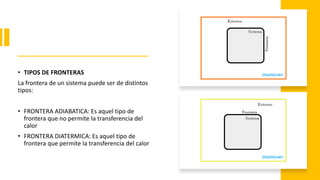
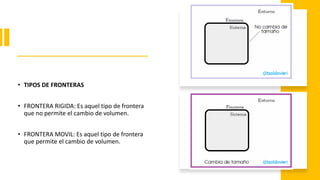
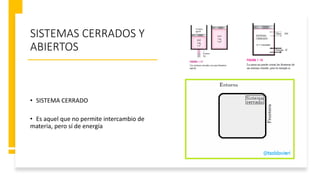
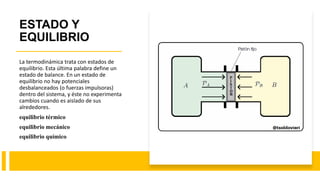
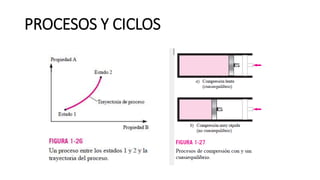
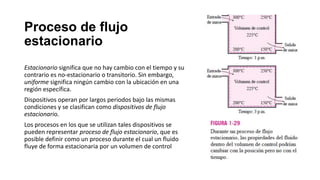
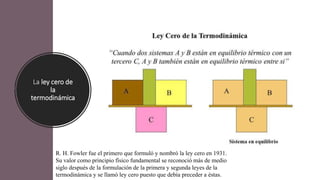
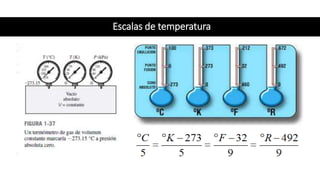
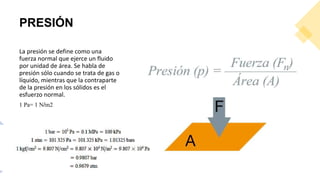
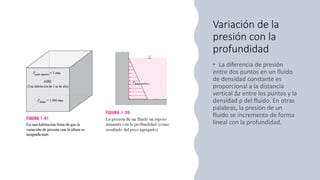
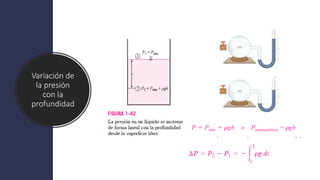
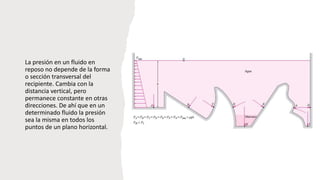
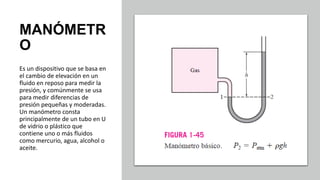
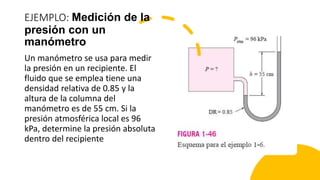
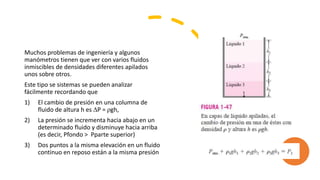
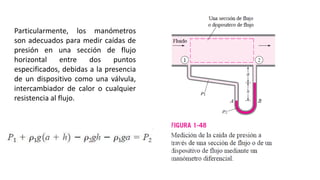
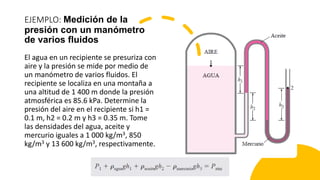
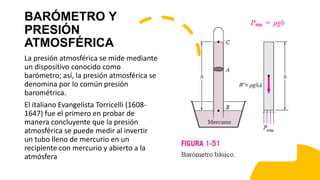
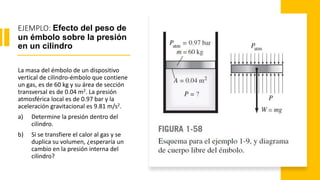
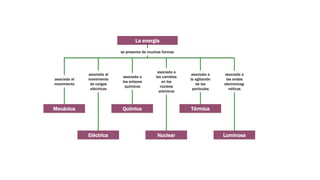
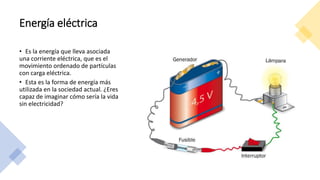
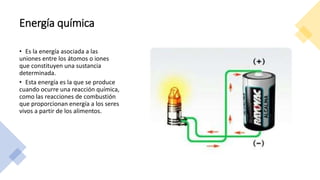
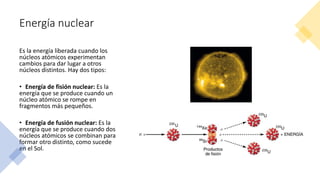
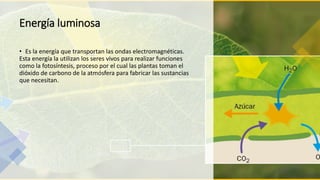
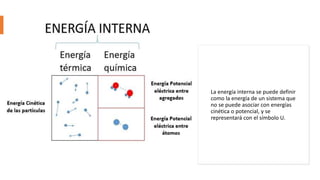
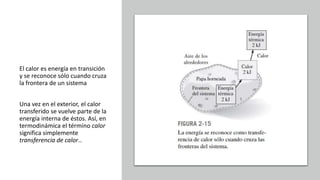
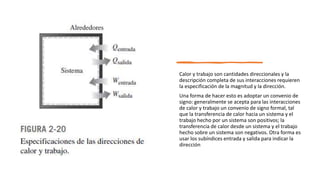
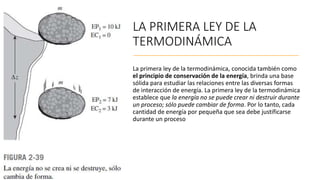
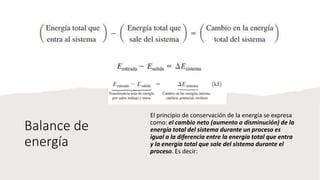
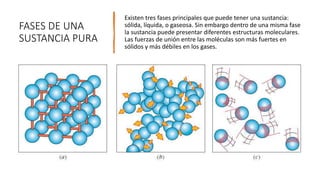
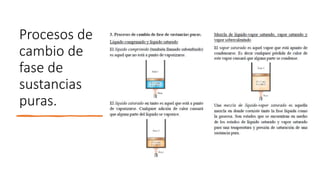
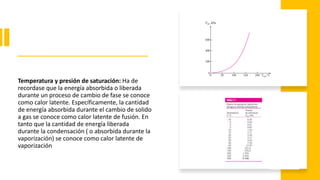
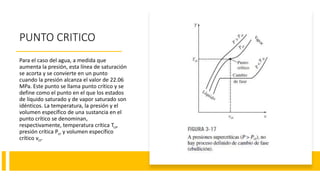
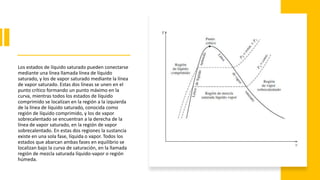
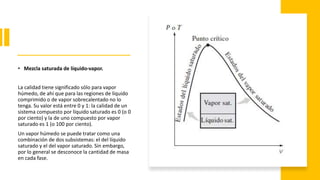
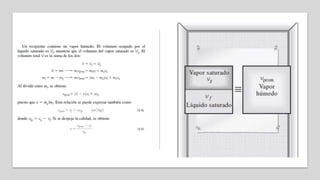
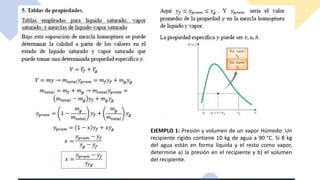
Este documento trata sobre la termodinámica. Explica que la termodinámica estudia la energía en sus diversas formas y cómo se puede extraer y convertir. Describe las leyes de la termodinámica, incluida la primera ley sobre la conservación de la energía. También explica conceptos clave como sistema, estado, equilibrio, procesos y ciclos termodinámicos. Finalmente, cubre temas como temperatura, presión, densidad y su medición.