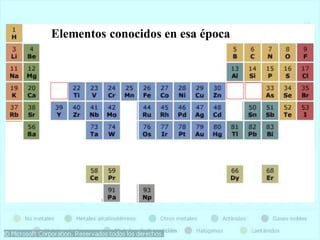
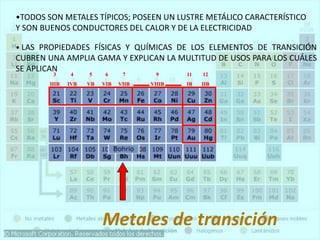
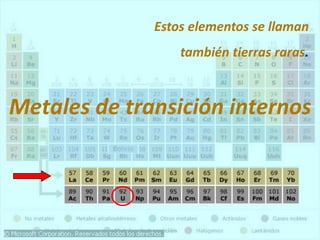
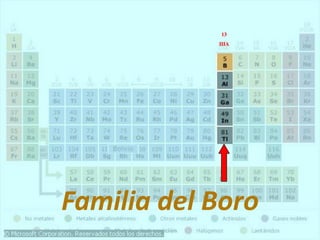
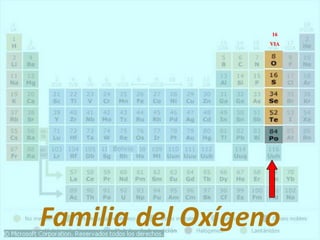
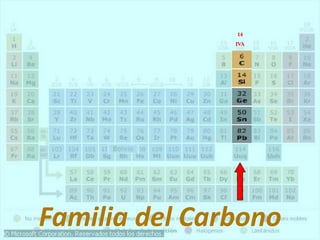
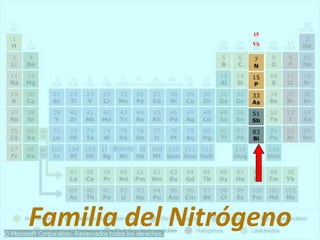
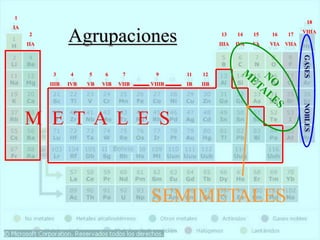
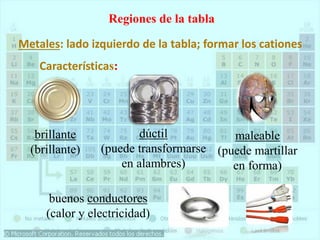
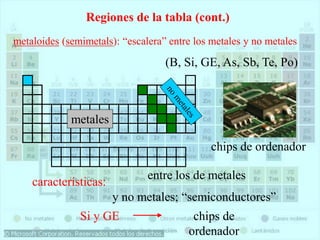
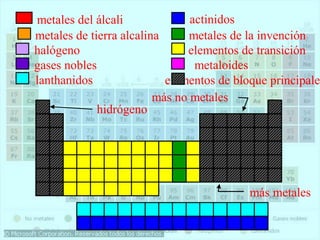
El documento describe la historia del desarrollo de la tabla periódica de los elementos a través del trabajo de varios químicos durante el siglo XIX. Johann Dobereiner clasificó elementos en grupos de tres con propiedades similares, mientras que John Newlands propuso ordenarlos en "octavas". Finalmente, Dmitri Mendeleev y Lothar Meyer publicaron las primeras tablas periódicas ordenando los elementos por masa atómica y dejando espacios para elementos aún desconocidos.