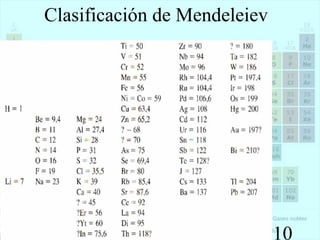
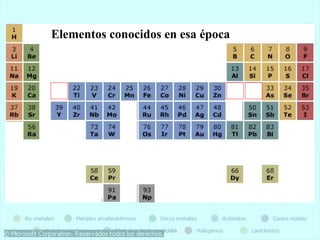
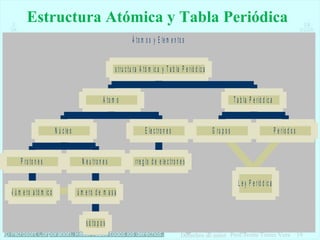
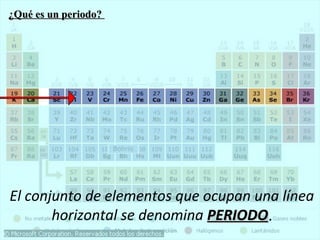
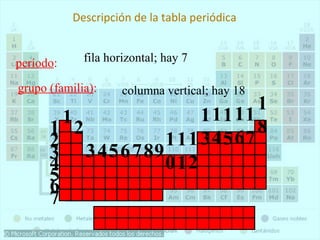
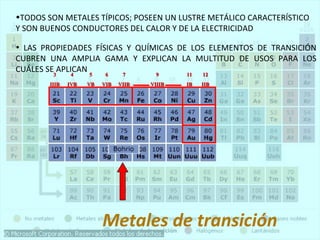
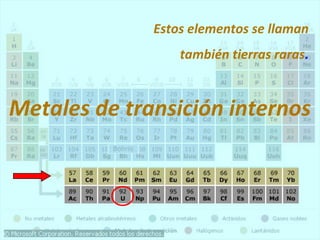
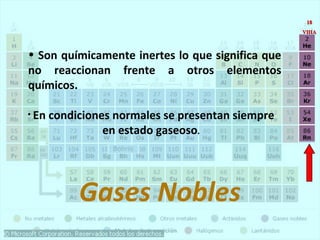
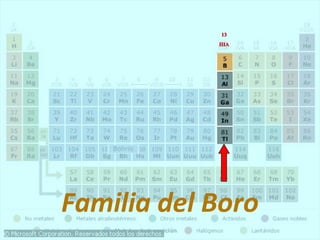
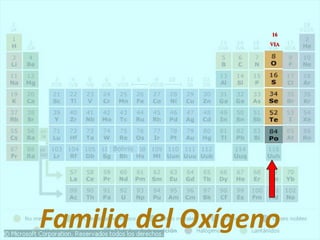
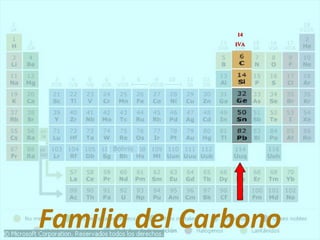
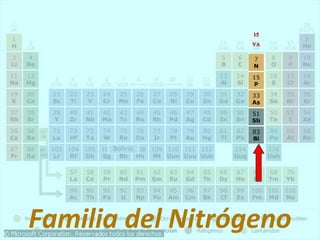
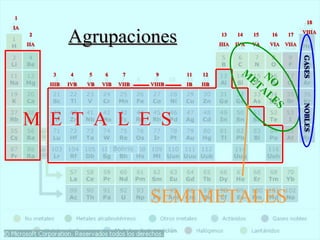
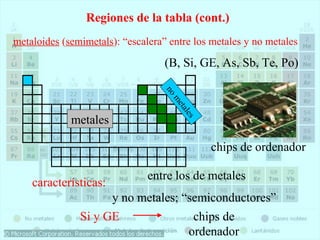
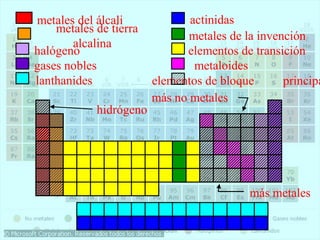
Este documento presenta la historia y estructura de la tabla periódica. Explica que en el siglo XIX los químicos comenzaron a clasificar los elementos conocidos de acuerdo a sus propiedades físicas y químicas. Científicos como Dobereiner, Newlands, Mendeleev y Meyer contribuyeron al desarrollo de la tabla periódica moderna mediante la organización de los elementos de acuerdo a sus masas atómicas y propiedades periódicas. Finalmente, Moseley reagrupó los elementos en orden cre