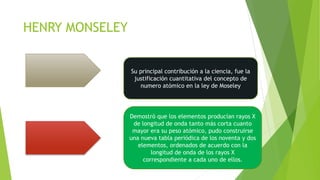
Este documento proporciona información sobre la tabla periódica, incluyendo su historia, estructura y clasificación de los elementos químicos. Explica que la tabla periódica organiza los elementos de acuerdo a sus propiedades periódicas y características, con 18 columnas verticales llamadas grupos y 7 filas horizontales llamadas períodos. Además, resume los principales antecedentes históricos de la tabla periódica y describe las diferentes familias y grupos de elementos como los metales, no metales y gases nobles.