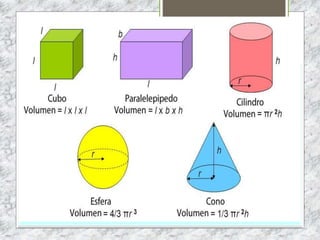
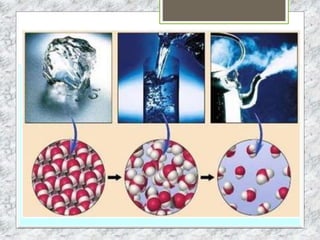
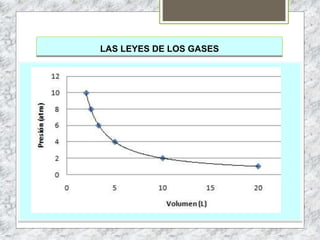
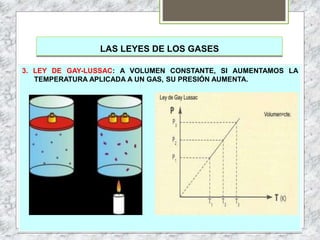
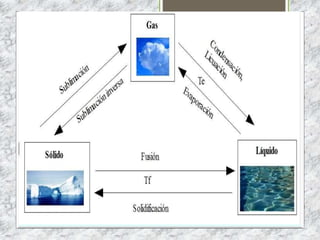
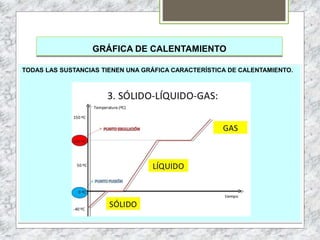
Este documento proporciona una introducción a la materia y sus propiedades. Explica que la materia es todo lo que tiene masa y ocupa un espacio, y describe las propiedades intensivas y extensivas. Luego discute los estados de la materia (sólido, líquido y gaseoso) y presenta el modelo cinético molecular para explicarlos. También cubre las leyes de los gases y los diferentes tipos de cambios de estado de la materia.