Mapa conceptual quimica
•Descargar como PPTX, PDF•
0 recomendaciones•1,640 vistas
Denunciar
Compartir
Denunciar
Compartir
Recomendados
Recomendados
Más contenido relacionado
La actualidad más candente
La actualidad más candente (19)
Determinación del valor calorífico del gas natural

Determinación del valor calorífico del gas natural
Similar a Mapa conceptual quimica
Similar a Mapa conceptual quimica (20)
Mapa conceptual quimica
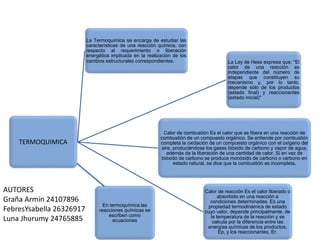
- 1. TERMOQUIMICA La Termoquímica se encarga de estudiar las características de una reacción química, con respecto al requerimiento o liberación energética implicada en la realización de los cambios estructurales correspondientes. La Ley de Hess expresa que: "El calor de una reacción es independiente del número de etapas que constituyen su mecanismo y, por lo tanto, depende sólo de los productos (estado final) y reaccionantes (estado inicial)" Calor de combustión Es el calor que se libera en una reacción de combustión de un compuesto orgánico. Se entiende por combustión completa la oxidación de un compuesto orgánico con el oxígeno del aire, produciéndose los gases bióxido de carbono y vapor de agua, además de la liberación de una cantidad de calor. Si en vez de bióxido de carbono se produce monóxido de carbono o carbono en estado natural, se dice que la combustión es incompleta. Calor de reacción Es el calor liberado o absorbido en una reacción a condiciones determinadas. Es una propiedad termodinámica de estado cuyo valor, depende principalmente, de la temperatura de la reacción y se calcula por la diferencia entre las energías químicas de los productos, Ep, y los reaccionantes, Er. En termoquímica las reacciones químicas se escriben como ecuaciones AUTORES Graña Armin 24107896 FebresYsabella 26326917 Luna Jhurumy 24765885
