Un 8 1.-_energia_termica_1-5
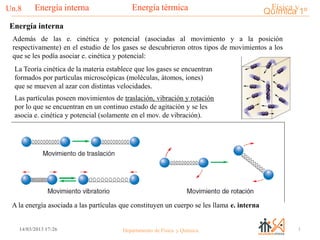
- 1. Física yQuímica 1ºEnergía térmicaUn.8___________________________________________________________________Energía interna 114/03/2013 17:26 Departamento de Física y Química Además de las e. cinética y potencial (asociadas al movimiento y a la posición respectivamente) en el estudio de los gases se descubrieron otros tipos de movimientos a los que se les podía asociar e. cinética y potencial: La Teoría cinética de la materia establece que los gases se encuentran formados por partículas microscópicas (moléculas, átomos, iones) que se mueven al azar con distintas velocidades. Las partículas poseen movimientos de traslación, vibración y rotación por lo que se encuentran en un continuo estado de agitación y se les asocia e. cinética y potencial (solamente en el mov. de vibración). A la energía asociada a las partículas que constituyen un cuerpo se les llama e. interna Energía interna
- 2. Física yQuímica 1ºEnergía térmicaUn.8___________________________________________________________________Energía interna 214/03/2013 17:26 Departamento de Física y Química La teoría cinética se puede aplicar a líquidos y sólidos: en los sólidos, no son posibles los movimientos de rotación y traslación, mientras que en los líquidos la situación es intermedia. Los tres estados de agregación de la materia al microscopio
- 3. Física yQuímica 1ºEnergía térmicaUn.8___________________________________________________________________Energía interna 314/03/2013 17:26 Departamento de Física y Química La temperatura es una magnitud que nos informa sobre el estado de agitación de las partículas de un cuerpo. Es decir, existe una relación directa entre la temperatura y la energía cinética de las partículas, de tal forma que cuanto mayor es la energía cinética de las partículas, mayor es la temperatura del cuerpo. La teoría cinética demuestra que la temperatura de un cuerpo es directamente proporcional al valor medio de las energías cinéticas de las partículas. T = k <Ec> T es la temperatura del gas en la escala absoluta o Kelvin k es una constante universal, igual para todos los gases La temperatura en el SI se expresa la escala absoluta o Kelvin, sin embargo no es la única escala. Son muy usuales la escala centígrada o Celsius y la escala Fahrenheit. Temperatura y calor Escalas de temperaturas La temperatura no puede medirse directamente sino por otras magnitudes que varían con la temperatura: dilatación de un líquido o un gas etc.
- 4. Física yQuímica 1ºEnergía térmicaUn.7_____________________________________________________________________Temperatura y calor 414/03/2013 17:26 Departamento de Física y Química T(K) = t(ºC) + 273,15 La conversión de temperaturas entre ellas es: Escala absoluta o Kelvin: 273 Punto de Fusión o congelación 373 Punto de ebullición Se divide en 100 partes iguales Escala Farenheit: 32º Punto de Fusión o congelación 212º Punto de ebullición Se divide en 180 partes iguales Escala Celsius: 0º Punto de Fusión o congelación 100º Punto de ebullición Se divide en 100 partes iguales 180 32)F(ºT 100 )C(ºT
- 5. Física yQuímica 1ºEnergía térmicaUn.7_____________________________________________________________________Temperatura y calor 514/03/2013 17:26 Departamento de Física y Química Cero absoluto de temperatura Se conoce como cero absoluto al límite de temperatura inferior de un cuerpo. Este valor es inalcanzable y se corresponde con el cero en la escala Kelvin. Por tanto, a diferencia de Celsius y Fahrenheit, en la escala Kelvin no existen temperaturas negativas ya que no es posible un valor promedio negativo de energía cinética. Aunque existe un valor mínimo de temperatura, no existe un valor máximo de esta.