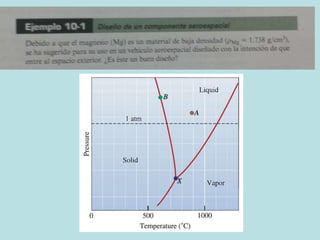
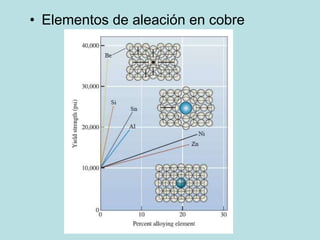
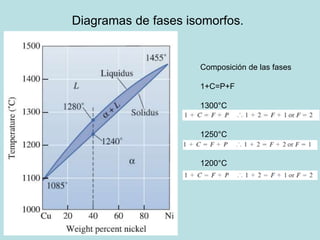
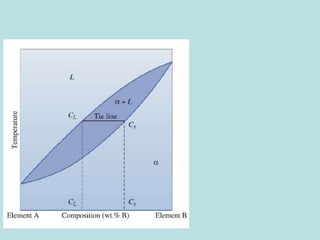
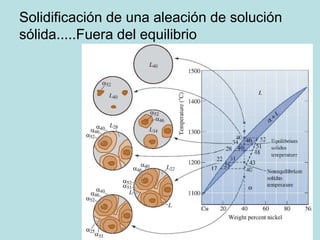
Este documento trata sobre las soluciones sólidas y el equilibrio de fases en las aleaciones metálicas. Explica que las soluciones sólidas contienen dos o más elementos disueltos en una matriz metálica y que controlan las propiedades mecánicas. También define conceptos clave como fase, diagrama de fases y solubilidad, y describe cómo estas afectan la formación y propiedades de las aleaciones.