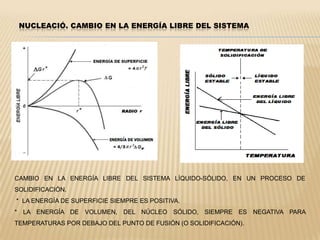
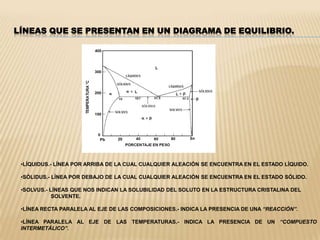
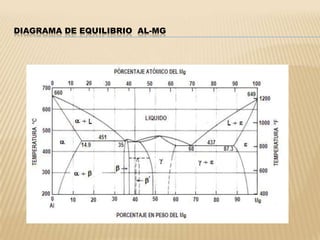
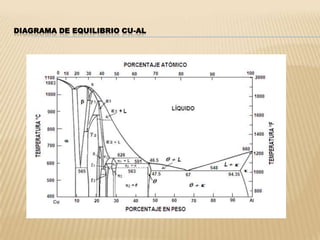
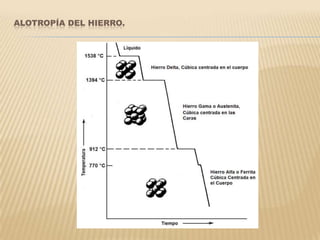
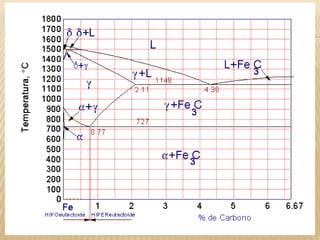
Este documento clasifica los procesos de manufactura y describe los diferentes tipos de conformado de materiales. Se dividen los procesos en conformado primario, conformado por deformación, conformado por corte, conformado por unión y conformado por tratamiento. Dentro de cada categoría, se enumeran y describen brevemente los diferentes procesos.























![Leyes de fick* PRIMERA LEY DE FICK.- PARA FENÓMENOS DE DIFUSIÓN INDEPENDIENTES DEL TIEMPO.DONDE: J = FLUJO DE ÁTOMOS [ ÁTOMOS/CM2 SEG] D = COEFICIENTE DE DIFUSIÓN [ CM2/SEG] C = CONCENTRACIÓN DE ÁTOMOS [ÁTOMOS/CM3]SEGUNDA LEY FICK.- PARA FENÓMENOS DEPENDIENTES TANTO DEL TIEMPO COMO LA POSICIÓN, ES DECIR, C = f(x,t), SE TIENE UNA EXPRESIÓN DE LA FORMA:CUYA SOLUCIÓN ES DE LA FORMA](https://image.slidesharecdn.com/materialesdeusoeningeniera1-110320133834-phpapp02/85/Presentacion-1-27-320.jpg)
![LEYES DE FICKDONDE: CS = CONCENTRACIÓN EN LA SUPERFICIE DEL METAL CO = CONCENTRACIÓN ORIGINAL DEL METAL CX = CONCENTRACIÓN EN EL PUNTO X X = DISTANCIA DESDE LA SUPERFICIE HACIA EL INTERIOR DEL METAL t = TIEMPO EN seg D = COEFICIENTE DE DIFUSIÓN [cm2/seg]EL COEFICIENTE DE DIFUSIÓN DEPENDE DE LA TEMPERATURA EN FORMA EXPONENCIAL Y ESTÁ DADO POR LA SIGUIENTE EXPRESIÓN:DONDE: DO = CTE [cm2/seg] QD = ENERGÍA DE ACTIVACIÓN PARA LA DIFUSIÓN [Kcal/mol]R = CTE = 1.987 [cal/mol OK] T = TEMPERATURA [OK]](https://image.slidesharecdn.com/materialesdeusoeningeniera1-110320133834-phpapp02/85/Presentacion-1-28-320.jpg)