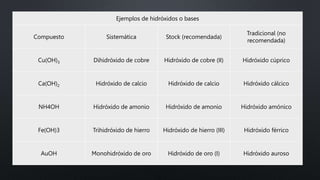
El documento describe las propiedades de los ácidos y bases. Explica que los ácidos emiten iones de hidrógeno en el agua y forman sales con metales, tienen sabor agrio y cambian el color de indicadores. También describe ácidos fuertes y débiles, así como bases fuertes y débiles según su capacidad para ionizarse.