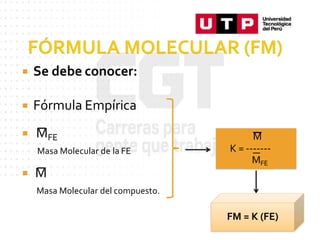
Este documento trata sobre las unidades químicas de masa. Explica conceptos como la unidad de masa atómica (uma), la masa atómica, la masa molecular, el mol y el número de Avogadro. Además, describe cómo se usan estas unidades para calcular la cantidad de átomos o moléculas presentes en una muestra, así como para resolver problemas. Finalmente, incluye ejemplos de ejercicios sobre estas unidades.