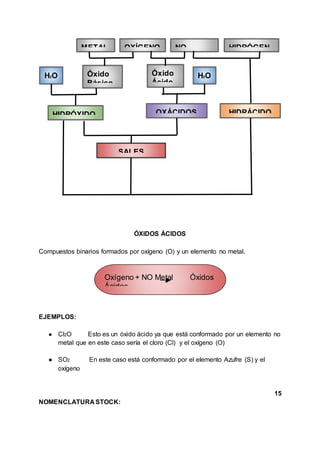
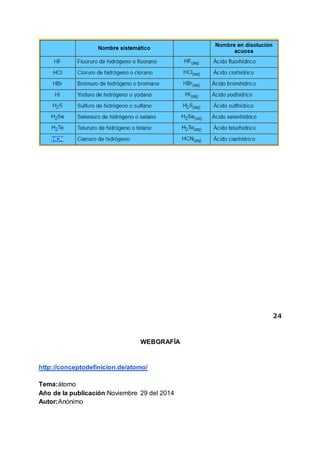
Este documento presenta un resumen de los principales temas de química vistos en el primer período académico. Inicia explicando conceptos básicos como átomo, masa atómica e isótopos. Luego aborda temas como moles, mol, número de Avogadro, fórmulas, cálculo porcentual y estado de oxidación. Finaliza detallando los diferentes métodos de nomenclatura química como óxidos ácidos, básicos, hidroxidos y oxácidos.