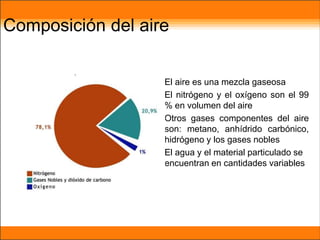
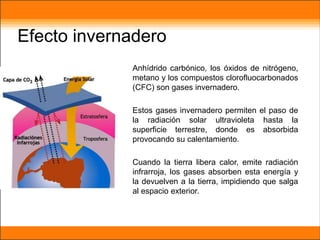
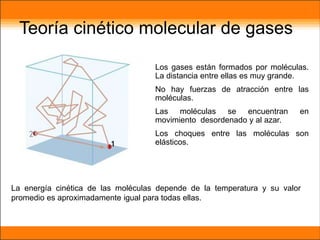
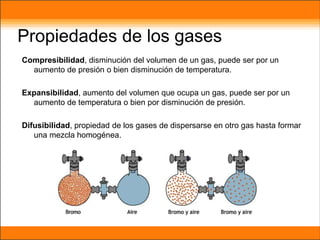
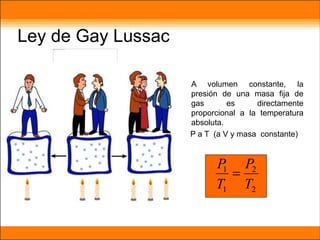
El aire está compuesto principalmente de nitrógeno y oxígeno. Aproximadamente necesitamos 14 kg de aire por día para respirar, el cual contiene un 20.9% de oxígeno necesario para que plantas y animales sobrevivan. Los gases en la atmósfera como el dióxido de carbono y el metano atrapan el calor de la Tierra y causan el efecto invernadero.