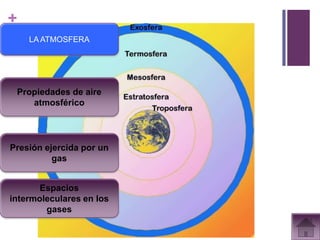
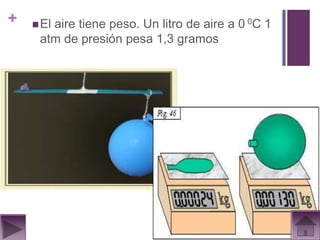
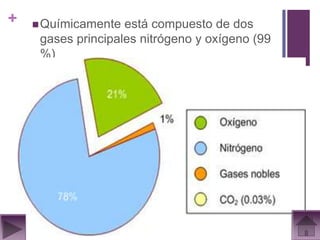
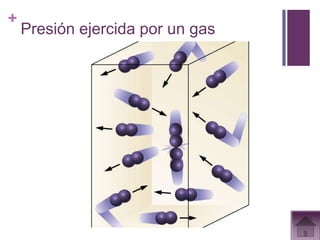
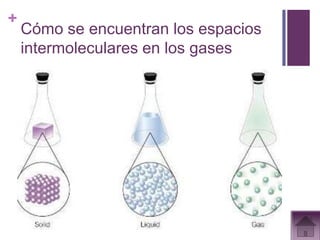
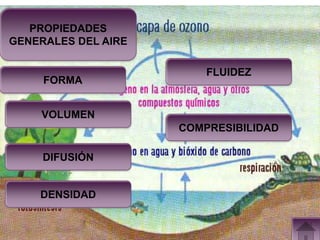
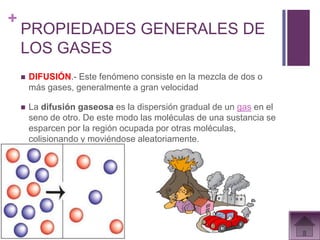
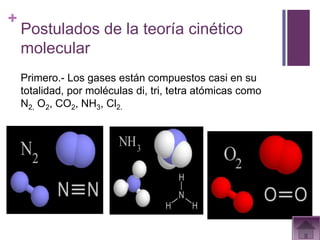
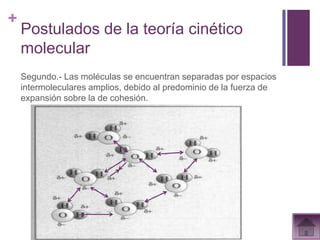
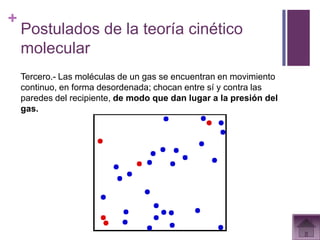
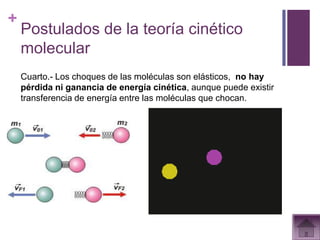
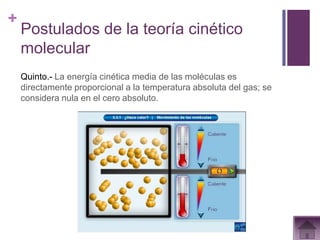
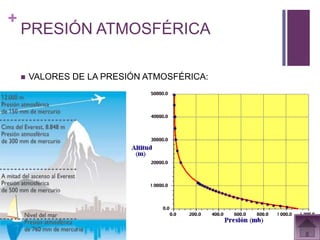
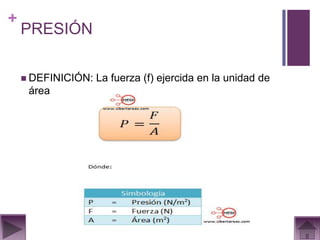
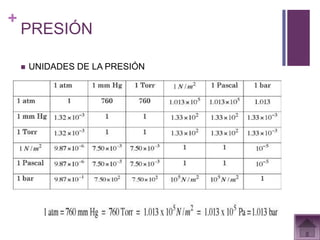
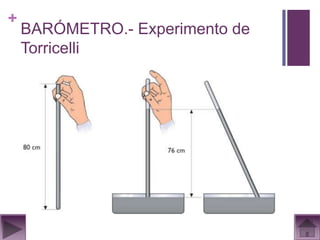
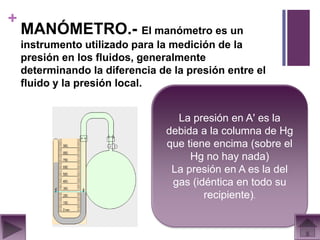
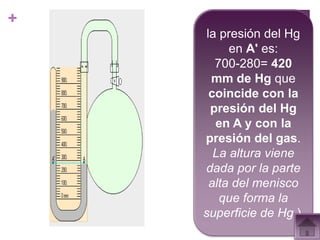
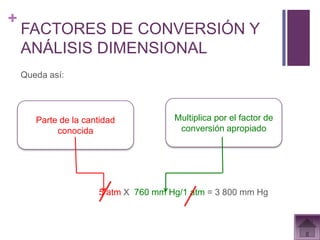
Este documento presenta información sobre los estados gaseosos y propiedades de los gases. Explica conceptos como la teoría cinética molecular de los gases, propiedades generales como forma, volumen y densidad. También cubre temas como la presión atmosférica, factores que afectan la presión de los gases, y formas de medir la presión como el barómetro y manómetro.