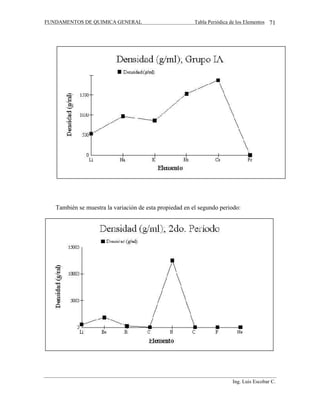
Este documento trata sobre unidades en química. Explica las magnitudes fundamentales y derivadas, y los sistemas de unidades CGS y SI. Define conceptos como masa, volumen, densidad, gravedad específica y notación científica. Incluye factores de conversión entre unidades y ejemplos numéricos para ilustrar los cálculos químicos.
























































































































































































![FUNDAMENTOS DE QUIMICA GENERAL Estado Líquido
Ing. Luis Escobar C.
188
9. Una solución que contiene 3,24 g de un soluto no volátil no electrólito y 200 g de agua
hierve a 100,13C a una atmósfera. Cuál es el peso molecular del soluto. Resp. 64
10. Cuál es el punto de solidificación de una solución acuosa al 10% en peso de CH3OH.
Resp. – 6,5C
11. Calcular el punto de congelación de un fenol (C6H5OH) impurificado con un 1% de
agua. El fenol puro solidifica a 40,8C y su Kc es 7,3 C/m. Resp. 36,7C
12. Calcular la presión osmótica a 20C de una solución de ácido fórmico, HCOOH, que
contiene 1 g de sustancia por litro. Resp. 397 mmHg
13. La presión osmótica de una solución de lactosa, C12H22O11, a 18C es de 3,54 atm. La
densidad de la solución es 1,015 g/ml. Calcular la molaridad, la molalidad y el punto de
congelación de la solución. Resp. 0,1483 M; 0,1539 m; – 0,286C
14. Se disuelven 3,96 g de ácido benzóico, C6H5COOH, en 80,6 g de benceno, C6H6 y la
solución se congela a 4,47C. El benceno puro congela a 5,5C. Hallar el peso
molecular y la fórmula de ácido benzóico disuelto en el benceno. Kc de benceno es 5,12
C/m. Resp. 244,3; (C6H5COOH)2
15. Cuántos gramos de alcohol etílico, C2H5OH, deben agregarse a un litro de agua para
que la solución no se congele a –20C. Resp. 495 g
16. Una solución que contiene 2,70 g de una proteína disueltos en 100 g de agua tiene una
presión osmótica de 9,12 mmHg a 33˚C. Calcular el peso molecular de la proteína.
Resp. 55000
17. Si el radiador de un automóvil contiene 12 litros de agua, cuánto descenderá el punto de
congelación mediante la adición de 5 kg de prestol [glicol, C2H4(OH)2]. Resp. 12C
18. Una solución de un pigmento proteínico que se extrae de los cangrejos, se preparó
disolviendo 0,750 g de la proteína en 125 cm3
de agua. A 4C, se observó un aumento
en la presión osmótica de 2,6 mm. La solución tiene una densidad de 1 g/ml. Calcular el
peso molecular de la proteína. Resp. 5,4x105
19. La presión osmótica de la sangre es 7,65 atmósferas a 37C. Qué cantidad de glucosa,
C6H12O6, se debe utilizar por litro para una inyección intravenosa para que tenga la
misma presión osmótica de la sangre. Resp. 54,3 g
20. A 40C la presión de vapor, en torr, de las soluciones de alcohol metílico y alcohol
etílico está representada por la siguiente ecuación:
135
)
OH
CH
(
X
119
Pv 3
Cuáles son las presiones de vapor de los componentes puros a esta temperatura. Resp.
254 torr; 135 torr](https://image.slidesharecdn.com/escobarquimicageneral150710233934lva-210830191919/85/Escobar-quimica-general-186-320.jpg)




![FUNDAMENTOS DE QUIMICA GENERAL Acidos, Bases y Sales
Ing. Luis Escobar C.
193
ÁCIDO Ka
HClO4
HI
HBr
HCl
HNO3
H2SO4
HIO3
H2C2O4
HNO2
HF
HC2H3O2
H3BO3
HCN
muy grande
muy grande
muy grande
muy grande
muy grande
muy grande
0,17
5,9x10–2
4,6x10–4
3,5x10–4
1,8x10–5
7,3x10–10
4,9x10–10
Para BASES:
BASE Kb
NaOH
KOH
LiOH
Etiamina, C2H5NH2
Metilamina, CH3NH2
NH3, NH4OH
Piridina, C5H5N
Anilina, C6H5NH2
muy grande
muy grande
muy grande
5,6x10–5
4,2x10–4
1,8x10–5
1,5x10–9
4,2x10–10
4. AUTOIONIZACION DEL AGUA:
El agua puede actuar como un ácido y como una base, por tanto, es una sustancia anfótera.
Cuando reacciona consigo mismo los hace de la siguiente manera:
H2O + H2O H3O+
+ OH–
También puede autoionizarse:H2O H+
+ OH–
Como la ionización del agua es un equilibrio:
O
H
OH
H
equilibrio
K
2
Como el agua se encuentra en forma de moléculas no ionizadas, cualquier valor de su grado
de ionización influye muy poco en la concentración de las moléculas. Por eso la [H2O] se
puede considerar constante, entonces:](https://image.slidesharecdn.com/escobarquimicageneral150710233934lva-210830191919/85/Escobar-quimica-general-191-320.jpg)
![FUNDAMENTOS DE QUIMICA GENERAL Acidos, Bases y Sales
Ing. Luis Escobar C.
194
OH
H
O
H
o
Kequilibri 2
Donde el producto: (Kequilibrio)([H2O]) se denomina Kw, conocida como CONSTANTE
DEL PRODUCTO IONICO DEL AGUA:
OH
H
Kw
A 25C Kw es igual a 1x10–14
, por tanto:
14
10
x
1
OH
H
Kw
Cuando cambia la temperatura, cambia el valor de Kw; esto podemos observar en la
siguiente tabla:
TEMPERATURA (˚C) Kw
0 1,13x10–15
10 2,92x10–15
25
37
1,00x10–14
2.40x10–14
45 4,02x10–14
60 9,61x10–14
De la ecuación anterior podemos concluir que:
a) Una solución es NEUTRA, si: [H+
] = [OH–
] = 1x10–7
M
b) En una solución ACIDA, se cumple que: [H+
] [OH–
]
c) En una solución BASICA, se cumple que: [H+
] [OH–
]
5. EL pH:
Determinar el pH de una solución, es determinar cuantitativamente la concentración de
iones hidrógeno, [H+
]. Sörensen, estableció una expresión matemática que nos indica el
grado de acidez de toda solución, que es igual a:
pH
10
H
H
log
pH
De la ecuación anterior se puede establecer las siguientes conclusiones:
a) Una solución es NEUTRA si: pH = 7
b) Una solución es ACIDA cuando el pH 7
c) Una solución es BASICA, si pH 7
De donde se puede establecer la siguiente escala de pH:](https://image.slidesharecdn.com/escobarquimicageneral150710233934lva-210830191919/85/Escobar-quimica-general-192-320.jpg)


![FUNDAMENTOS DE QUIMICA GENERAL Acidos, Bases y Sales
Ing. Luis Escobar C.
197
Simplificando la ecuación anterior, tenemos:
OH
H
Ka
Kh
Donde: 14
10
x
1
Kw
OH
H
Ka
Kh
Por tanto: Kw
Ka
Kh
Ka
Kw
Kh
El porcentaje de hidrólisis de una sal, se calcula de la siguiente manera:
100
Inicial
ión
Concentrac
a
Hidrolizad
ión
Concentrac
Hidrólisis
%
Si se considera una SAL ÁCIDA, la constante de hidrólisis se define mediante la
siguiente ecuación:
Kb
Kw
Kh
PROBLEMAS RESUELTOS:
1. Calcular la [H+
] y [OH–
] en una solución 0,100M de ácido acético, HC2H3O2, cuya
constante Ka es 1,75x10–5
.
La reacción de ionización es:
HC2H3O2 H+
+ C2H3O2
–
I: 0,100 0 0
E: 0,100 – X X X
Definiendo la constante de ionización para el ácido acético, tenemos:
]
O
H
HC
[
]
O
H
C
][
H
[
Ka
2
3
2
2
3
2
Reemplazando datos tenemos:
X
100
,
0
X
10
x
75
,
1
2
5
De donde se obtiene la siguiente ecuación de segundo grado:](https://image.slidesharecdn.com/escobarquimicageneral150710233934lva-210830191919/85/Escobar-quimica-general-195-320.jpg)
![FUNDAMENTOS DE QUIMICA GENERAL Acidos, Bases y Sales
Ing. Luis Escobar C.
198
0
10
x
75
,
1
X
10
x
75
,
1
X 6
5
2
Resolviendo esta ecuación, obtenemos los siguientes resultados: X1 = 1,3142x10–3
X2 = –1,3317x10–3
Valores de X negativos, no son solución para nuestro problema ya que no podemos
hablar de concentraciones negativas, por lo que:
X = [H+
] = 1,3142x10–3
moles/litro
Aplicando la constante del producto iónico del agua (Kw), podemos determinar la
concentración de iones hidróxido:
Kw = [H+
][OH–
] = 1x10–14
Despejando [OH–
] y reemplazando datos tenemos:
litro
/
moles
10
x
6092
,
6
10
x
3142
,
1
10
x
1
OH 12
3
14
2. Calcular el pH y el porcentaje de ionización de una solución 1M de ácido cianhídrico
(HCN), si la Ka es 4,8x10–10
.
El HCN se ioniza mediante la siguiente reacción:
HCN H+
+ CN–
I: 1 0 0
E: 1–X X X
Reemplazando datos tenemos:
X
1
X
X
1
X
X
10
x
8
,
4
2
10
X2
+ 4,8x10–10
X – 4,8x10–11
= 0
X = [H+
] = 2,19x10–5
moles/litro
Definiendo el pH, como:
pH = – log [H+
]
pH = – log(2,19x10–5
) = 4,65](https://image.slidesharecdn.com/escobarquimicageneral150710233934lva-210830191919/85/Escobar-quimica-general-196-320.jpg)

![FUNDAMENTOS DE QUIMICA GENERAL Acidos, Bases y Sales
Ing. Luis Escobar C.
200
Reemplazando datos tenemos:
X
072
,
0
X
Ka
2
Como el pH es 2,7; entonces: [H+
] = X = 10–2,7
= 1,9953x10–3
moles/litro; por tanto:
3
2
3
10
x
9953
,
1
072
,
0
)
10
x
9953
,
1
(
Ka
5
10
x
6871
,
5
Ka
5. Calcular el pH de una solución acuosa de ácido clorhídrico de concentración 5x10–8
M.
La ionización del HCl es total, como se muestra a continuación:
HCl H+
+ Cl–
I: 5x10–8
0 0
E: 0 5x10–8
5x10–8
Como es una solución acuosa muy diluida, hay que tomar en cuenta la ionización del
agua, que aporta con una [H+
] de 1x10–7
moles/litro, por lo tanto:
[H+
]TOTAL = 5x10–8
+ 1x10–7
= 1,5x10–7
moles/litro
Entonces: pH = – log (1,5x10–7
) pH = 6,82
6. Calcular el pH y el % de hidrólisis de una solución 0,100 M de acetato de sodio,
NaC2H3O2, si Ka del ácido acético es 1,75x10–5
.
Consideramos la ionización de la sal:
NaC2H3O2 C2H3O2
–
+ Na+
I: 0,100 0 0
E: 0 0,100 0,100
Tomando en cuenta la hidrólisis, podemos escribir:
C2H3O2
–
HC2H3O2 + OH–
I: 0,100 0 0
E: 0,100 – X X X](https://image.slidesharecdn.com/escobarquimicageneral150710233934lva-210830191919/85/Escobar-quimica-general-198-320.jpg)
![FUNDAMENTOS DE QUIMICA GENERAL Acidos, Bases y Sales
Ing. Luis Escobar C.
201
Definiendo la constante de hidrólisis y calculando su valor, tenemos:
Ka
Kw
Kh
10
5
14
10
x
7143
,
5
10
x
75
,
1
10
x
1
Kh
Reemplazando en la ecuación de la hidrólisis, podemos escribir:
X
100
,
0
X
10
x
7143
,
5
2
10
De donde obtenemos la ecuación: X2
+ 5,7143x10–10
X – 5,7143x10–11
= 0; que al
resolverla se encuentra que X = 7,5590x10–6
y que corresponde a [OH–
].
Por lo que podemos calcular el pOH:
pOH = – log [OH–
]
pOH = – log (7,5590x10–6
) = 5,12
Como: pH + pOH = 14 pH = 14 – 5,12 = 8,88; corresponde a una solución básica ya
que el NaC2H3O2 es una sal básica.
El porcentaje de hidrólisis se calcula de la siguiente manera:
100
Inicial
ión
Concentrac
a
Hidrolizad
ión
Concentrac
Hidrólisis
%
100
100
,
0
10
x
5590
,
7
Hidrólisis
%
6
3
10
x
5590
,
7
Hidrólisis
%
7. Calcular el pH y el % de hidrólisis de una solución 0,02M de cloruro de amonio,
NH4Cl, si Kb del hidróxido de amonio es 1,8x10–5
.
Las reacciones de ionización e hidrólisis, se muestran a continuación:](https://image.slidesharecdn.com/escobarquimicageneral150710233934lva-210830191919/85/Escobar-quimica-general-199-320.jpg)
![FUNDAMENTOS DE QUIMICA GENERAL Acidos, Bases y Sales
Ing. Luis Escobar C.
202
NH4Cl NH4
+
+ Cl–
I: 0,02 0 0
E: 0 0,02 0,02
NH4
+
NH4OH + H+
I: 0,02 0 0
E: 0,02 – X X X
Tomando en cuenta la hidrólisis, podemos escribir:
Kb
Kw
Kh
Reemplazando datos tenemos:
10
5
14
10
x
5556
,
5
10
x
8
,
1
10
x
1
Kh
X
02
,
0
X
10
x
5556
,
5
2
10
X = [H+
] = 3,3330x10–6
moles/litro
De donde:
pH = – log [H+
] = – log (3,3330x10–6
) = 5,47
El NH4Cl es una sal ácida, por lo tanto su pH es ácido.
El porcentaje de hidrólisis se determina así:
100
Inicial
ión
Concentrac
a
Hidrolizad
ión
Concentrac
Hidrólisis
%
100
02
,
0
10
x
3330
,
3
Hidrólisis
%
6
0167
,
0
Hidrólisis
% %](https://image.slidesharecdn.com/escobarquimicageneral150710233934lva-210830191919/85/Escobar-quimica-general-200-320.jpg)
![FUNDAMENTOS DE QUIMICA GENERAL Acidos, Bases y Sales
Ing. Luis Escobar C.
203
PROBLEMAS PROPUESTOS:
1. Calcular la [H+
] y la [OH–
] en una solución 0,010 N de una base débil que esta ionizada
el 1,3%. Cuál es el pH de la solución. Resp. 7,7x10–11 moles/litro; 1,3x10–4
moles/litro; 10,11
2. Calcular el pH y el pOH de las soluciones, suponiendo una ionización completa: a)
ácido 0,00345 N; b) base 0,00886 N. Resp. a) 2,46 y 11,54; b) 11,95 y 2,05
3. El amoniaco líquido a –50C se ioniza produciendo NH4
+
y NH2
–
. Su producto iónico
es [NH4
+
][NH2
–
]=1x10–30
. Cuántos iones NH2
–
, están presentes por cada mm3
de
amoniaco líquido. Resp. 602 iones
4. Una solución de ácido acético, HC2H3O2, (Ka=1,8x10–5
) esta ionizada en un 1%.
Calcular [H+
] de la solución. Resp. 1,8x10–3 moles/litro
5. Cuál es el porcentaje de ionización de una solución que contiene 100 g de ácido acético
disuelto en agua para producir 1000 ml de solución. Resp. 0,33%
6. Una solución de ácido fórmico, HCO2H, 0,0010 M, está ionizada en un 34%. Calcular
la constante de ionización del ácido. Resp. 1,8x10–4
7. Calcular Ka para el ácido fluorhídrico, HF, si se encuentra ionizado en un 9% en
solución 0,10 M. Resp. 8,9x10–4
8. Calcular el porcentaje de ionización de una solución de ácido acético 0,045 M.
Ka(HC2H3O2) es 1,75x10–5
. Resp. 2%
9. Una solución de amoníaco esta ionizada en un 2,5%. Determinar la concentración molar
de la solución y el pH. Resp. 0,0273; 10,83
10. Calcular la concentración de una solución de acetato de sodio cuyo pH es 8,97. Ka del
ácido acético 1,8x10–5
. Resp. 0,18 M
11. Calcular el volumen de una solución de amoníaco 0,15 N que se encuentra ionizada 1%
y que contiene la misma cantidad de iones OH–
que 0,50 litros de una solución de
hidróxido de sodio 0,20 N. Resp. 67 litros
12. Una solución 1 M de metilamina, CH3NH2, tiene un pH de 12,32. Calcular la constante
de ionización del ácido. Resp. 4,4x10–4
13. Calcular el pH y el porcentaje de hidrólisis que ocurre en una solución de acetato de
sodio, NaC2H3O2, 1x10–3
M. Resp. 7,87; 7,5x10–2%
14. Calcular el pH y el porcentaje de hidrólisis de una solución de cloruro de amonio,
NH4Cl, 2x10–3
M. Resp. 5,98; 5,3x10–2%](https://image.slidesharecdn.com/escobarquimicageneral150710233934lva-210830191919/85/Escobar-quimica-general-201-320.jpg)
![FUNDAMENTOS DE QUIMICA GENERAL Acidos, Bases y Sales
Ing. Luis Escobar C.
204
15. Calcular la [H+
], [C2H3O2
–
] y [C7H5O2
–
] en una solución que contiene HC2H3O2 0,02 M
y HC7H5O2 0,01 M. Las constantes de ionización para el HC2H3O2 y el HC7H5O2 son
respectivamente 1,75x10–5
y 6,46x10–5
. Resp. 1x10–3; 3,5x10–4; 6,5x10–4
16. El valor de Kw a la temperatura fisiológica de 37C es 2,4x10–14
. Cuál es el pH en el
punto neutro del agua a esta temperatura. Resp. 6,81
17. Una solución 0,25 M de cloruro de piridonio, C5H6N+
Cl–
se encontró que tiene un pH
de 2,93. Cuál es el valor de Kb para la ionización de la piridina, C5H5N. Resp. 1,8x10–9
18. Una solución contiene 25 g de hidróxido de amonio en 500 ml de solución. Cuál es el
pH de la solución a 25C. Resp. 11,71
19. Una solución 0,20 M de una sal de NaX tiene un pH de 10,96. Determinar el valor de
Ka para el ácido HX. Resp. 2,4x10–9
20. Una solución 0,18 M del ácido débil HA tiene un pH de 3,80. Calcular el pH de una
solución 0,25 M de la sal NaA. Resp. 10,13](https://image.slidesharecdn.com/escobarquimicageneral150710233934lva-210830191919/85/Escobar-quimica-general-202-320.jpg)












![FUNDAMENTOS DE QUIMICA GENERAL Termoquímica
Ing. Luis Escobar C.
217
13. La ecuación termoquímica en la combustión del metileno gas es:
mol
/
kcal
337
Hr
)
g
(
O
H
2
)
g
(
CO
2
)
g
(
O
)
g
(
H
C 2
2
2
4
2
Admitiendo un rendimiento del 70%. Cuántos kilogramos de H2O a 20C pueden
convertirse en vapor, mediante la combustión de 1000 litros de etileno en condiciones
normales.
Determinamos las moles en condiciones normales, correspondientes a los 1000 litros de
metano:
4
2
4
2
4
2
4
2 H
C
moles
64
,
44
H
C
litros
4
,
22
H
C
mol
1
H
C
litros
1000
Así mismo determinamos la cantidad de calor producida por las 44,64 moles:
kcal
68
,
15043
H
C
mol
1
kcal
337
H
C
moles
64
,
44
4
2
4
2
Entonces:
kcal
38
,
10530
)
68
,
15043
(
70
,
0
o
aprovechad
Q
Determinamos la masa de agua:
)
n
evaporació
(
m
T
cp
m
Q
)
g
cal
540
(
m
C
)
20
100
(
)
C
g
cal
1
(
m
58
,
10530
→ O
H
kg
98
,
16
m 2
14. Calcular o
f
H
del CO(g), utilizando la ley de Hess y a partir de los siguientes datos:
mol
/
kcal
1
,
94
)]
g
(
CO
[
H 2
o
f
; mol
/
kcal
7
,
67
Hr
)
g
(
CO
)
g
(
O
)
g
(
CO 2
2
Es necesario determinar la entalpía de la reacción:
)
g
(
CO
)
g
(
O
2
1
)
s
(
C 2
Para resolver el problema, planteamos las siguientes reacciones químicas:](https://image.slidesharecdn.com/escobarquimicageneral150710233934lva-210830191919/85/Escobar-quimica-general-215-320.jpg)
![FUNDAMENTOS DE QUIMICA GENERAL Termoquímica
Ing. Luis Escobar C.
218
)
2
(
mol
/
kcal
7
,
67
Hr
)
g
(
CO
)
g
(
O
2
1
)
s
(
CO
)
1
(
mol
/
kcal
1
,
94
Hr
)
g
(
CO
)
g
(
O
)
s
(
C
2
2
2
2
Restando (1) – (2), tenemos:
)
g
(
CO
)
g
(
O
2
1
)
s
(
C
0
)
g
(
CO
)
g
(
O
2
1
)
s
(
C
)
g
(
CO
)
g
(
CO
)
g
(
O
2
1
)
g
(
CO
)
g
(
O
)
s
(
C
2
2
2
2
2
2
La cantidad de calor se encuentra aplicando la misma operación:
mol
kcal
4
,
26
)
7
,
67
(
1
,
94
Hr
)
2
(
Hr
)
1
(
Hr
Hr
15. Calcular o
f
H
[CH4(g)] a partir de los siguientes datos:
)
3
(
mol
/
kJ
8
,
285
Hr
)
g
(
O
H
)
g
(
O
2
1
)
g
(
H
)
2
(
mol
/
kJ
5
,
393
Hr
)
g
(
CO
)
g
(
O
)
s
(
C
)
1
(
mol
/
kJ
887
Hr
)
g
(
O
H
2
)
g
(
CO
)
g
(
O
2
)
g
(
CH
2
2
2
2
2
2
2
2
4
Nos piden calcular el Hr
de la reacción: C(s) + 2 H2(g) CH4(g), para lo cual
realizamos el siguiente procedimiento matemático con las reacciones: (2) + 2(3) – (1);
el calor de la reacción en cuestión es:
mol
/
kcal
1
,
78
Hr
)
887
(
)
8
,
285
(
2
5
,
393
Hr
)
1
(
Hr
)
3
(
Hr
2
)
2
(
Hr
Hr
PROBLEMAS PROPUESTOS:
1. Cuántas calorías se necesitan para calentar desde 15C hasta 65C, las siguientes
sustancias: a) 1 g de H2O; b) 20 g de platino. Resp. a) 50 cal; b) 32 cal
2. La combustión de 5 g de coque eleva la temperatura de un litro de agua desde 10C
hasta 47C. Calcular el poder calorífico del coque en kcal/g. Resp. 7,4 kcal/g](https://image.slidesharecdn.com/escobarquimicageneral150710233934lva-210830191919/85/Escobar-quimica-general-216-320.jpg)

















