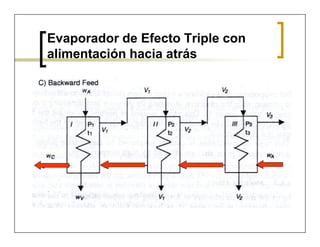
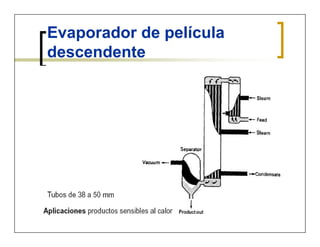
Este documento describe el proceso de evaporación. Define evaporación como la operación en la cual se elimina el vapor formado por ebullición de una solución líquida para obtener una solución más concentrada. Explica que la evaporación es comúnmente usada para remover agua de productos líquidos diluidos. También presenta ejemplos de aplicaciones de evaporación en diversas industrias como la agroalimentaria, farmacéutica, química y de polímeros. Finalmente, describe los diferentes tipos de evaporadores y las ecuaciones de balance de materia