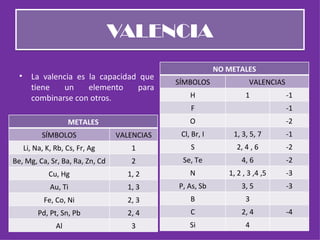
El documento explica diferentes sistemas de nomenclatura química para nombrar compuestos en función de su composición o fórmula química, incluyendo nomenclatura tradicional, sistemática y de Stock para óxidos, peróxidos, hidruros metálicos, hidrácidos, hidruros volátiles e hidróxidos. También cubre la nomenclatura de sales binarias y ácidos/sales oxácidos/oxisales.