Marcha analítica de cationes
- 1. 33 UNIVERSIDAD DE ORIENTE NÚCLEO DE BOLÍVAR UNIDAD DE ESTUDIOS BÁSICOS QUÍMICA EXPERIMENTAL MARCHA ANALÍTICA DE CATIONES OBJETIVOS: a. Separación, mediante la marcha analítica de cationes de los grupos: I, II, III y siguientes. b. Separación e identificación de los cationes del grupo I. c. Separación e identificación de los cationes del grupo III-A. TEORÍA: GENERALIDADES SOBRE LA MARCHA ANALÍTICA: El método ideal para la determinación de la presencia de un cierto ión en una solución, consiste en utilizar reactivos específicos de dicho ión, ello implica disponer de una cierta cantidad de reactivos, uno para cada ión, lo que es bastante difícil de lograr. Con el fin de utilizar el mínimo número de reactivos y que además no se produzcan interferencias, se han desarrollado las llamadas Marchas Analíticas, ya sea de aniones o cationes. La Marcha Analítica de Cationes más empleada, es la que desarrollara Bunsen en el siglo pasado. En dicha Marcha, se clasifican los cationes de cinco grupos. Cada grupo es separado de los demás, mediante el agregado de reactivos específicos de cada grupo, los cuales precipitan los cationes correspondientes en forma específica, es decir, el reactivo de un grupo precipita los cationes correspondientes a dicho grupo, pero los cationes de los demás grupos quedan en solución. De acuerdo a esto, existen cinco Reactivos de Grupo, a saber: SUB- GRUPO CATIONES REACTIVO PRECIPITADO GRUPO I Ag + , Hg +2 , Pb +2 HCl diluido AgCl, Hg2Cl2, PbCl2 +2 +2 +3 +2 Hg , Pb , Bi , Cu , A H2S en HCl 0,25 M HgS, PbS, Bi2S3, CuS, CdS Cd+2 HCl + CH3CSNH2 + II A Fe+2, Mn+2, Ni+2, Co+2 FeS, MnS, NiS, CoS NH4OH B AsO-3, HCl + CH3CSNH2 + III B Cr+3, Al+3, Sn+2 Cr(OH)3, Al(OH)3, SnS NH4OH (NH4)2CO3, BaCO3, SrCO3, IV Ba+2, Sr+2, Ca+2 CaCO3 V Mg+2, Na+, K+, NH4+ Ningún Grupo Soluble
- 2. 34 Los reactivos de grupo, se agregan en forma sucesiva, separando cada precipitado antes de agregar a la solución sobrenadante, el reactivo correspondiente al grupo siguiente. Es así, como al finalizar la separación de cada uno de los grupos, dispondremos de cuatro precipitados (de los cuatro primeros grupos), y una solución con el grupo V, siempre y cuando, en la solución original hubiere todos los cationes de los cinco grupos. Es entonces cuando podemos determinar la presencia de los elementos que componen cada grupo, empleando reactivos específicos sobre cada precipitado. GENERALIDADES SOBRE LA PRECIPITACIÓN DE SUSTANCIAS POCO SOLUBLES. Si dos iones A-m y B+n se combinan para formar un electrolito fuerte pero poco soluble (50 g/l o menos) An Bm de acuerdo a: n A-m + m B+n = An Bm (1) Entonces en toda solución en donde estén presentes los iones en cuestión, el producto (A-m )n y (B+n )m no podrá exceder de un cierto valor Kps, al cual se le denomina Producto de Solubilidad de An Bm. El valor de Kps de An Bm dependerá de la naturaleza de dicha sustancia y de la temperatura. En resumen: Cuando el sistema de iones A-m y B+n en solución, está en equilibrio, deberá cumplirse que: (A-m)neq x (B+n)meq = Kps ( An Bm ) (2) CONDICIONES PARA LA PRODUCCIÓN DE UN PRECIPITADO. De acuerdo con lo anterior, para que en el seno de una solución se forme un precipitado del compuesto poco soluble AnBm , solamente es necesario que haya en la solución iones A-m y B+n, cualquiera sea su origen y en cantidad tal que : (A-m)neq x (B+n)meq = Kps ( An Bm ) (3) En tal caso, precipitará An Bm según la reacción (1), sustrayendo así iones A-m y B+n a la solución. Esta precipitación seguirá efectuándose hasta que las concentraciones de dichos iones cumplan la reacción (2). Es obvio que los valores de las concentraciones de los iones en equilibrio, dependerán de los valores iniciales de las concentraciones correspondientes antes de la precipitación. Si se cumple lo dicho anteriormente, podríamos lograr que la concentración de cierto ión B+n en una solución, disminuya tanto como queramos, bastaría para ello el agregar suficiente cantidad de un electrolito fuerte que provea el ión A-m . En tal caso, al
- 3. 35 cumplirse (1), si la concentración de A-m es lo suficientemente grande, la oncentración de B+n se puede hacer pequeña. Este fenómeno se denomina Efecto del Ión Común. Limitaciones de la Solubilidad: Como hemos visto anteriormente, la formación de un precipitado se favorece por el efecto del ión común. Sin embargo, hay otros dos factores fundamentales que actúan en competencia con este efecto, tratando de impedir la precipitación, ellos son: a. Efecto Salino: Se ha observado que la solubilidad de un electrolito poco soluble, aumenta por el agregado de un electrolito fuerte, esto se denomina Efecto Salino. En consecuencia, una gran concentración del electrolito precipitante podría tener efectos contraproducentes en la precipitación, debido a este efecto. b. Formación de iones complejos: Un ión complejo es aquel formado por la unión de un ión simple con uno o más iones o moléculas. Por ejemplo: Cu+2 + 4 NH3 = Cu(NH3)4+2 (4) Ag+ + 2 Cl- = AgCl2- (5) Este fenómeno puede afectar negativamente a la formación de un precipitado, tal como sucede al querer precipitar Ag+ con el ión Cl- para formar AgCl. En tal caso, la producción del complejo por la reacción (5), si la concentración de Cl- es muy grande, y siendo dicho complejo soluble, impediría que precipitara el ión Ag+ en la cantidad que correspondería al efecto del Ión Común. Factores que afectan la Solubilidad de una Sustancia: Entre los más importantes podemos citar: a. La Temperatura.- En general, al aumentar la temperatura, aumenta la solubilidad. Este efecto puede ser grande o pequeño, dependiendo de la sustancia, por ello, cuando un precipitado se filtra en caliente, se logra que éste sea más puro. b. El Solvente.- La solubilidad de la mayoría de los compuestos inorgánicos, disminuye cuando se agrega a la solución acuosa, un solvente orgánico, tal como un alcohol (metanol, etanol, etc.) c. El pH.- La solubilidad de la mayoría de los precipitados se ve afectada por la concentración de los iones hidrógeno, e hidroxilo del solvente. Se puede distinguir dos efectos: el primero, es el Efecto del Ión Común, cuando el ión H+ o el OH- forman parte del precipitado; el segundo, en caso de un complejo, resulta de las consecuencias de la reacción de formación de un complejo entre uno de los iones que precipita y el H+ o el OH- .
- 4. 36 ANÁLISIS DEL GRUPO I DE CATIONES: (Ag+, Hg+2, Pb+2) El grupo I de cationes está formado por aquellos cationes cuyos elementos son insolubles en agua y en ácidos diluidos. Los productos de solubilidad a 25 °C de los cloruros correspondientes a estos iones son: Kps(AgCl) = 1,6x10-10, Kps (Hg2Cl2) = 1 x10-18 y Kps (PbCl2) = 1,7x10-5 . Precipitación del Grupo I: Conviene primero acidificar la solución con HNO3 por que la muestra normalmente es neutra o alcalina, el Ag+ puede estar presente como un complejo (Ag(NH3 )2 ) (argento diamina), y el Pb+2 como HPbO2- (anión plúmbico), los que son difíciles de precipitar con Cl- . Al agregar HNO3 se producirán las siguientes reacciones: Ag(NH3)2+ + 2 H+ = Ag+ + 2 NH4- HPbO2- + 3 H+ = Pb+2 + 2 H2O Se agrega a continuación HCl con el cual precipita los cloruros: AgCl, Hg2Cl2, y PbCl2 . Todos son de color blanco. Se emplea como precipitante HCl diluido, para evitar la formación de los complejos solubles de Ag y Pb, de acuerdo a las siguientes reacciones: AgCl(s) + Cl- = (AgCl)2 (soluble) PbCl2(s) + 2 Cl- = (PbCl4)= (soluble) La precipitación se hace agitando para favorecer la mezcla de los reactivos. Se realiza en frío pues el PbCl2 es mucho más soluble en caliente que en frio. Verificando que hay exceso de reactivo, se centrifuga para separar el precipitado de cloruros de la solución, que en principio podría tener el resto de los grupos. El precipitado se lava para eliminar restos de los otros grupos. Se utiliza HCl para lavar el precipitado, con el fin de evitar demasiada solubilización de los cloruros. Separación e Identificación del Pb+2 : Como el PbCl2 es mucho más soluble en agua caliente que en agua fría, la mezcla de cloruros precipitados se trata con agua caliente varias veces, de manera que, si hay PbCl2, éste queda en solución en el agua caliente dejando los cloruros de Ag y Hg como precipitado insoluble que se separa dicha solución de PbCl2. El PbCl2 disuelto, se identifica en la solución caliente mediante el agregado de una solución de K2CrO4, la que provee los iónes CrO4= para precipitar el PbCrO4 de color amarillo (Kps = 1,8x10-14) muy soluble, que se puede separar por centrifugación.
- 5. 37 Separación de Ag+ y Hg2 +2 : El precipitado de AgCl y Hg2Cl2 que es de color blanco, se trata con NH4OH moderadamente concentrado, que actúa disolviendo el AgCl según la reacción: AgCl(s) (blanco) + 2 NH3 = (Ag(NH3)2)+ + Cl- Por su parte, el Hg2Cl2 reacciona con NH3 : Hg2Cl2(s) (blanco) + 2 NH3 = Hg(l) (negro) + HgClNH2(s) (blanco) + NH4+ + Cl- (HgClNH2 se llama Cloroamiduro de Mercurio). Por lo tanto, si hay Hg2Cl2 , el precipitado tomará un color gris, que indica la presencia de Hg+2 cuando se agrega el NH4OH. Por lo tanto, si hay Hg2Cl2 , el precipitado tomará un color gris, que indica la presencia de Hg+2 cuando se agrega el NH4OH. Identificación de Ag+: La solución que contiene (Ag(NH3 )2 )+ resultante de la operación precedente, se trata con unas gotas de solución de KI, produciéndose la reacción: (Ag(NH3)2)+ + I- = AgI(s) (amarillo) + 2 NH3 La precipitación del AgI amarillo, indica la presencia de Ag+ Confirmación de Hg2+2 : Si bien, la presencia de un residuo gris en el tratamiento con NH4OH indica la presencia de Hg2 +2 conviene confirmarlo. Para ello, se disuelve el precipitado con una mezcla 1:3 en volumen de HNO3 y HCl (agua regia). La mezcla genera Cl- de acuerdo a la siguiente reacción: 2 NO3- + 8 H+ + 6 Cl- = 3 Cl2° + 2 NO + 4 H2O La disolución del precipitado, ocurre de acuerdo a: 3 Hg + 6 Cl- + 2 NO3- + 8 H+ = 3 HgCl2 (soluble) + 2 NO + 4 H2O HgClNH2(s) (blanco) + NO3- + 2 H+ + Cl- = HgCl2 (soluble) + NO + 2 H2O
- 6. 38 Se calienta el sistema para evaporar el resto del HNO3 se agrega unas gotas de solución de SnCl2 el cual reduce el Hg+2 a Hg2 +2 que con el Cl- que hay en el medio, da nuevamente un precipitado blanco de Hg2Cl2 lo que confirma la presencia de Hg. Las reacciones son: 2 Hg+2 + Sn+2 = Hg2+2 + Sn+4 Hg2+2 + 2 Cl- = Hg2Cl2(s) (blanco) La eliminación del HNO3 se hace necesaria para evitar que sea éste el que oxide al Sn+2 . MATERIAL EMPLEADO: Pipeta de 5 ml (graduada), tres pipetas de 1 ml (graduadas) o en su defecto 3 goteros, o frascos goteros, varilla de vidrio, centrífuga, mechero, trípode, tela metálica con amianto o asbesto, un vaso de 100 ml, 8 tubos para análisis semimicro, gradilla. REACTIVOS EMPLEADOS: Agua destilada; HNO3 4 N y concentrado; HCl 1 y 2 N; K2CrO4 s.r.; NH4OH 6 N, KI 1 N, SnCl2 s.r.; HCl concentrado, papel tornasol. PROCEDIMIENTO: El procedimiento a seguir para el análisis detallado de la solución problema, es que figura a continuación, en las indicaciones generales. Sin embargo, conviene hacer las aclaraciones que serán de suma utilidad para interpretar los esquemas de las Marchas Analíticas. INDICACIONES GENERALES: 1. Todas las medidas de volumen se realizarán contando el número de gotas correspondientes, adoptando la equivalencia: 1 ml. = 20 gotas. 2. Al centrifugar, se tomará la precaución de colocar en posición diametralmente opuesta al tubo con el medio a centrifugar, otro tubo idéntico conteniendo un volumen igual de agua. 3. Para decantar un precipitado, es decir, para separar un precipitado centrífugo de la solución sobrenadante, se trasvasa cuidadosamente esta última a otro tubo. 4. Cuando sea necesario lavar un precipitado ya decantado, se procede según el siguiente esquema: Precipitado (ppdo) + Líquido de lavado + agitar hasta suspensión del precipitado + centrifugar + decantar el precipitado ya lavado. 5. Cuando se dude la formación de un precipitado, conviene centrifugar y luego, observar si se depositó el precipitado en las paredes del tubo. 6. Siempre que se proceda a una separación por centrifugación, conviene que dicha precipitación sea completa. Para verificar esto, una vez agregado el reactivo precipitante, hay que centrifugar. Hecho lo cual, se agrega más reactivo precipitante haciéndolo deslizar por las paredes del tubo; si ocurre precipitación, esto quiere decir que aquella no era completa, entonces se repote
- 7. 39 el procedimiento hasta que no ocurra más precipitación al agregarle reactivo al líquido sobrenadante. MARCHA ANALÍTICA PARA EL ANÁLISIS DEL GRUPO I DE CATIONES: Tome 1 ml. de la solución problema en un tubo de ensayo y determine su reacción al papel tornasol, si la solución es neutra o alcalina, acidifique con 3 o 4 gotas de HNO3 4N. A esta solución ácida, agregue 2 gotas de HCl 1N, agite para ayudar a la formación de precipitado blanco. Centrifugue y decante. Agregue a la solución 1 gota de HCl 1N para comprobar si la precipitación fue completa. Si se forma un precipitado, agregue dos gotas mas de HCl 1N, agite, centrifugue y decante. El líquido resultante de estas últimas operaciones, contiene los cationes de los grupos II, III, IV y V. Rotúlelo y guárdelo. El precipitado (ppdo 1), contiene AgCl, PbCl2 y Hg2Cl2 . Antes de proceder a la separación e identificación de los cationes Pb+2 , Ag+ y Hg+2 , lave dicho precipitado con 10 gotas de agua y dos gotas de HCl 2N, descartando las aguas de lavado. SEPARACIÓN DEL Pb+2 : Añada al tubo de ensayo que contiene el precipitado 6 a 7 gotas de agua caliente. Remueva la mezcla con un agitador de vidrio, y caliente el tubo en baño de María, durante 2 a 5 minutos. Centrifugue y decante. El líquido (solución 2), consérvelo dentro del baño de María. Al precipitado (ppdo 2), lávelo con agua caliente por 2 a tres veces y guárdelo. No bote estas aguas de lavado, únalas, porque ellas pueden contener ión Pb+2 . IDENTIFICACIÓN DEL Pb+2 : La solución 2, contiene éste ión. Vierta una gota de ella dentro de un tubo de ensayo, y añádale un gota de K2 CrO4 S.R.. La formación de un precipitado amarillo, indica la presencia del catión Pb+2 en la solución problema. SEPARACIÓN DE LOS CATIONES Ag+ Y Hg+2 : El precipitado 2, contiene AgCl y Hg2 Cl2 . Agréguele de 4 a 5 gotas de NH4 OH 6N, agite, centrifugue, decante y guarde el líquido proveniente de este proceso. Si hay mucho precipitado, repita el tratamiento con NH4 OH 6N, uniendo los líquidos provenientes de las centrifugaciones respectivas. El líquido (solución 3), contiene el ión Ag+ . IDENTIFICACIÓN DEL CATIÓN Ag+ : Vierta una gota de la solución 3, en un tubo de ensayo, y agréguele una gota de KI 1M. Un precipitado amarillo pálido de AgI, indica la presencia de Ag+ en la solución problema.
- 8. 40 IDENTIFICACIÓN DEL CATIÓN Hg+2 : El ppdo 3, contiene Hg y HgClNH2 . Agréguele 3 gotas de HNO3 concentrado y 9 gotas de HCl concentrado. Transfiera el íquido obtenido como producto, a una cápsula de porcelana. Caliente a baño de María hasta que se evapore casi totalmente. Disuelva el residuo con 5 gotas de agua. Coloque dos gotas de la solución obtenida, en un tubo de ensayo, y añadale una gota de SnCl2 S.R. . Un precipitado blanco o gris, confirma la presencia de Hg+2 en la solución problema. CUESTIONARIO: 1. ¿Cuál es el significado del efecto salino? 2. Dada una solución saturada de ZnS en contacto de ZnS sólido, explique que podría hacer para procurar que se disolviera el sólido?. 3. Explique una razón por la cual el AgCl es más soluble en una solución de HNO3 que en agua pura. 4. ¿En qué se diferencia un ión complejo de un ión simple?. 5. ¿Porqué conviene acidificar una muestra desconocida antes de precipitar el Grupo I de cationes? 6. Explique cuál podría ser la razón por la cual el Pb puede encontrarse también en el Grupo II de cationes? 7. Explique porqué es necesario un ligero exceso de HCl para precipitar los cloruros del Grupo I?. 8. Explique porqué es perjudicial un gran exceso de HCl al precipitar los cloruros del Grupo I. BIBLIOGRAFÍA: WELCHER, Frank J. y Hann, B. "Semimicro Qualitative Analysis" TREADWELL, F. P. "Tratado de Química Analítica" Volumen I.
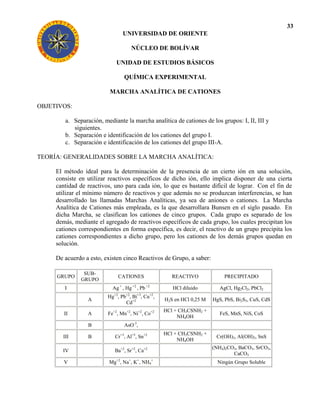
- 9. RECONOCIMIENTO DE CATIONES DEL GRUPO I 41 Ag+ , Hg2+2 , Pb+2 SOLUCIÓN PROBLEMA ( 1 ml.) SOLUCIÓN PRECIPITADO BLANCO AgCl,, PbCl2, Hg2Cl2 CATIONES DE LOS GRUPOS II, III, IV y V SOLUCIÓN PPDO. BLANCO DESCARTAR SOLUCIÓN DE Pb2 PPDO. BLANCO AgCl, Hg2Cl2 PPDO. AMARILLO SOLUCIÓN DE Ag+ PPDO. NEGRO Hg2ClNH2 PPDO. AMARILLO CONFIRMA Hg+2 VERDOSO
