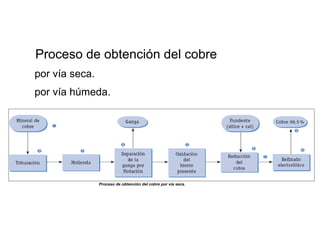
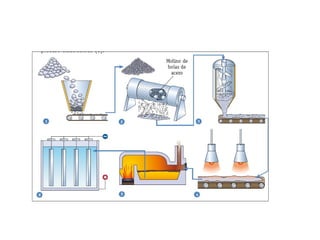
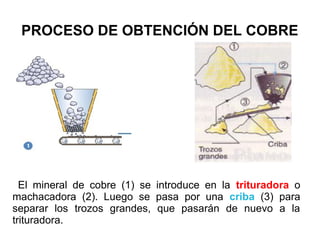
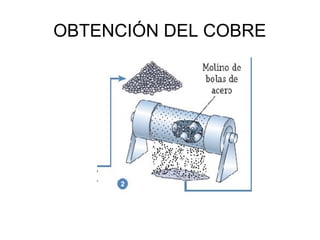
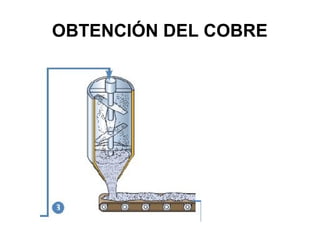
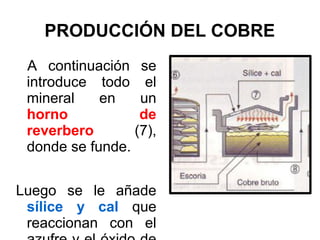
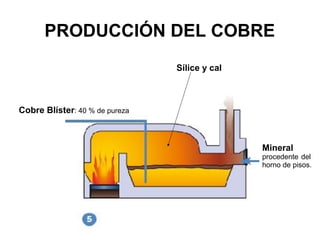
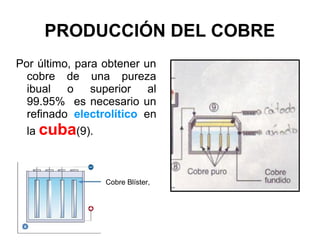
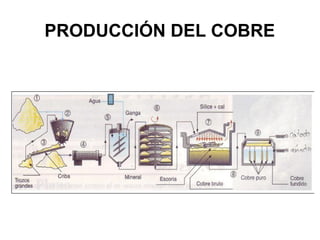
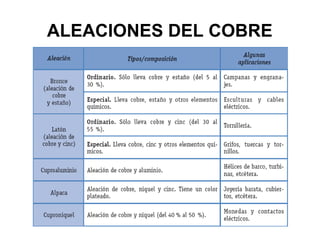
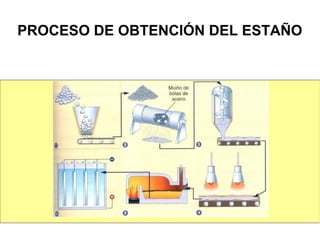
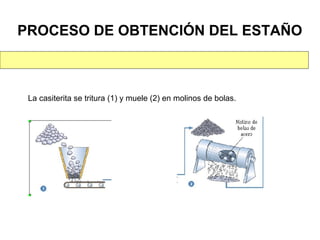
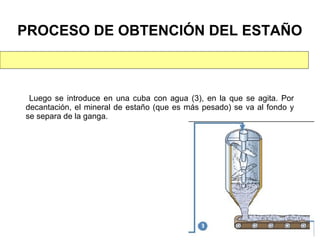
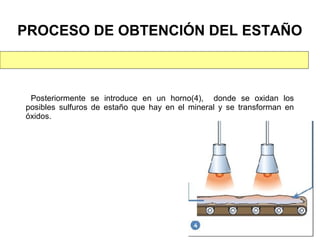
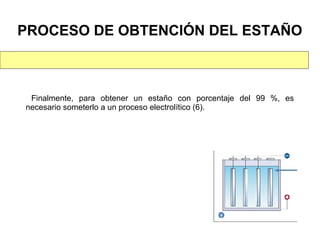
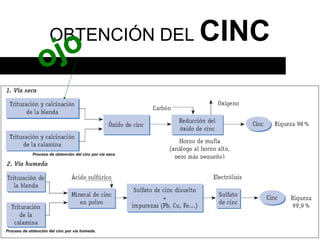
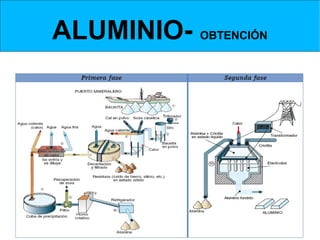
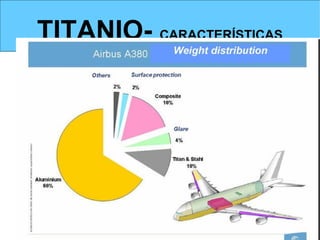
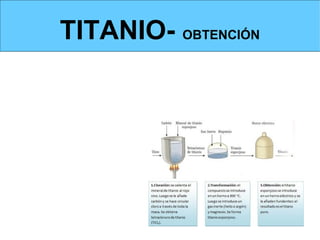
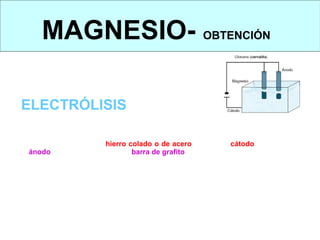
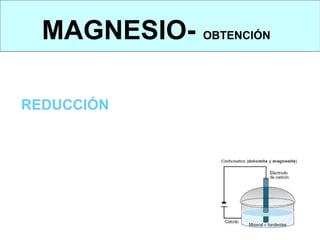
Este documento trata sobre los metales no ferrosos. Explica las propiedades generales de los metales no ferrosos como su resistencia a la oxidación, bajo peso específico y buena conductividad eléctrica. Luego, se enfoca en los procesos de obtención del cobre, estaño y cinc, incluyendo sus principales minerales y aleaciones.