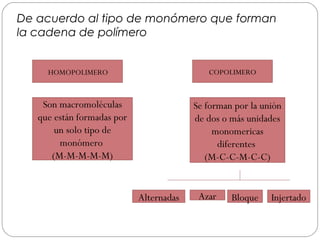
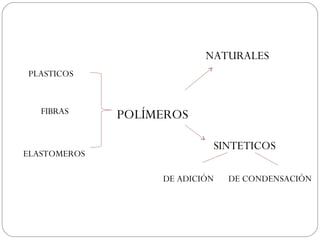
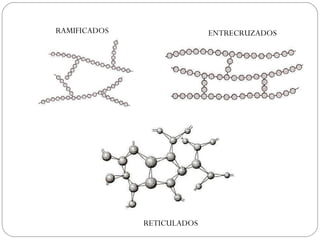
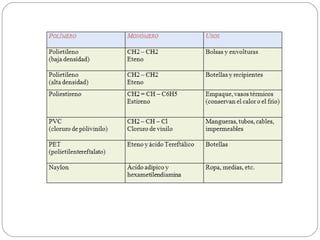
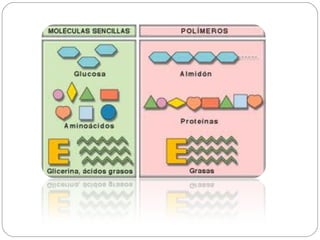
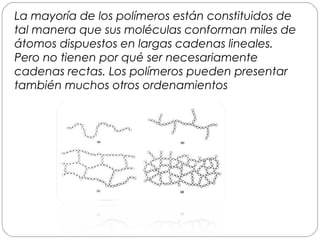
Este documento trata sobre los polímeros. Explica que son macromoléculas formadas por la unión repetida de monómeros unidos por enlaces covalentes. Los polímeros pueden ser naturales como la celulosa o sintéticos como el polietileno. También describe los tipos de estructura de los polímeros, cómo se obtienen los polímeros sintéticos y los impactos ambientales relacionados con su producción y uso.