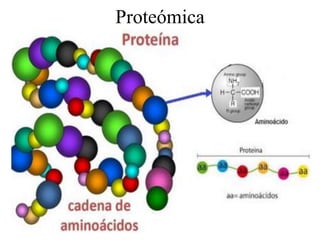
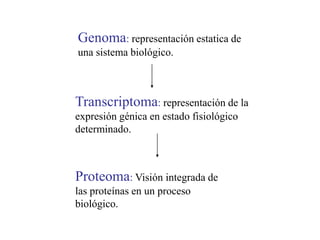
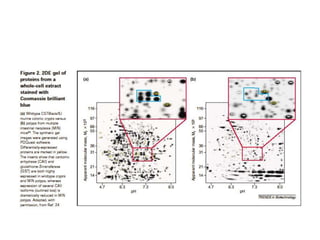
El documento describe la proteómica como el estudio y comprensión de los sistemas biológicos a través del análisis de las proteínas. Explica que la proteómica ofrece una visión integrada de las proteínas en un proceso biológico, mostrando información como las modificaciones postraduccionales que no pueden predecirse a partir de la secuencia de ADN. También describe los objetivos sistemáticos y pragmáticos de la proteómica y algunas de sus aplicaciones en medicina, toxicología