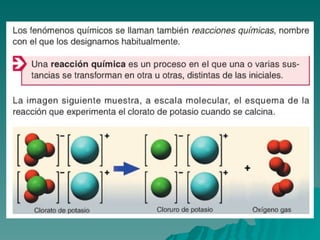
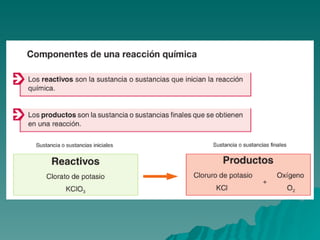
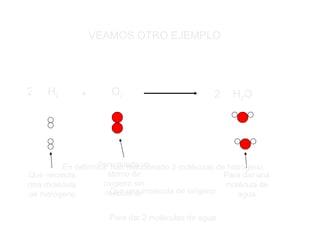
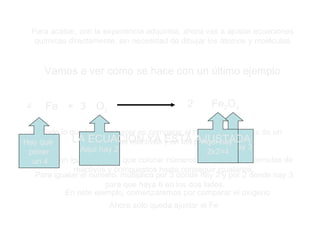
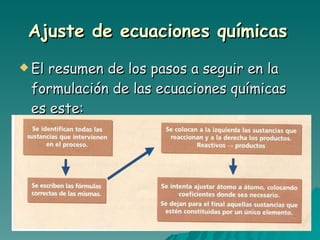
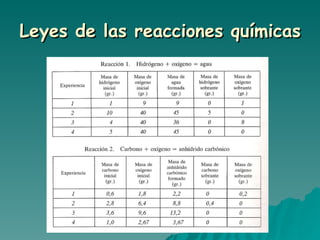
El documento trata sobre las transformaciones químicas y físicas, las ecuaciones químicas y las leyes de las reacciones químicas. Explica que en las transformaciones químicas las sustancias cambian su naturaleza al formarse nuevos productos, mientras que en las físicas no cambian. También describe cómo ajustar las ecuaciones químicas igualando los átomos de cada elemento en los reactivos y productos, y resume las leyes de conservación de la masa y de las proporciones definidas.